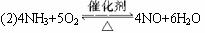题目内容
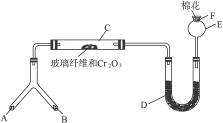
微型化学实验(简称ML)是绿色化学新理念在中学化学实验中的应用。微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等特点。下图是某同学设计的NH3的催化氧化(附着在玻璃纤维上的Cr2O3作催化剂)并检验反应生成的酸性物质的微观装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去),反应时需加热的部位是A、B、C。实验可提供的药品有:①NH4Cl、Ca(OH)2的混合物;②氨水;③KClO3和MnO2;④蒸馏水;⑤0.5 mol/L NaOH溶液;⑥酚酞试液;⑦浓H2SO4;⑧6 mol/L NaOH溶液。

试完成下列问题:
(1)微型叉形管中液态物质A是_____________,固体物质B是_____________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是_______________,实验过程中的现象是_____________。
(4)F处的棉花应蘸取的物质是_____________。
(1)氨水 KClO3和MnO2的混合物
(2)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3)0.5 mol/L NaOH溶液和酚酞试液 红色褪去
(4)碱性溶液,即为6 mol/L NaOH溶液(浓度大,对气体的吸收效果好)
解析:(1)实验者的目的是制取氨气并做氨的催化氧化实验,因此微型叉形管中必然产生NH3和O2。分析实验提供的药品,可得出液态物质A为氨水,固体物质B是KClO3和MnO2的混合物。
(2)由装置图可以看出:Cr2O3为氨的催化氧化的催化剂,C处发生反应的化学方程式4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(3)检验酸的方法常用酸碱指示剂或pH试纸,由题目所提供药品,只能选择0.5 mol/L NaOH溶液和酚酞试液,实验过程中的现象是红色褪去。
(4)由于反应生成的氨气少,空气量多,因此可基本保证氨气无剩余(即使剩余,也溶解在U形管内的D溶液中)。从溶液中逸出的气体可能为NO,与U形管上方的空气接触,生成NO2,故F处的棉花应蘸取的物质应是碱性溶液,即为6 mol/L NaOH溶液(浓度大,对气体的吸收效果好)。