题目内容
【题目】Sn 元素位于元素周期表第IVA 族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4 极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。注:在仪器3 中各加入0.6 mL浓硫酸,实验操作如下:
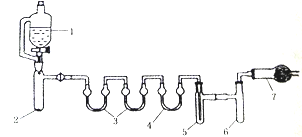
I.把干燥的仪器按图示装置连接好,在仪器1中加入B mL浓盐酸,在仪器2中加入2.0g KMnO4,在仪器5中加入2~3颗Sn粒;
II.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器6中;
III.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)写出仪券2中发生化学反应方程式________________________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检查装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6 可用冰水浴冷却,也可以自然冷却
(3)仪器7 放的试剂是_______________________,作用是___________________、__________________。
(4)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到___________________现象,化学方程式为___________________________________。
(5)经测定产品中含有少量的SnCl2,可能的原因___________( 用化学方程式表示)。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.400 g产品溶于50 mL的稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液8.00 mL,反应原理为:3SnCl2+ KIO3+ 6HCl==3SnCl4+ KI+ 3H2O,判断滴定终点的依据为______________________________,产品的纯 度为___________________________________。
【答案】 2KMnO4+16HCl(浓)=2KCl+2MmCl2+5Cl2↑+8H2O D 碱石灰 防止空气中水蒸气进入6中使SnCl4水解 吸收多余氯气防止污染空气 有大量白雾 SnCl4+(x+2)H2O=SuOx·xH2O+4HC1 Sn+2HC1=SnCl2+H2↑(或SuCl4+Sn=2SnC12) 当滴入最后一滴标准液,溶液出现蓝色且半分钟不褪色 88.6%
【解析】(1)高锰酸钾溶液与浓盐酸反应生成氯化锰、氯化钾、氯气和水,化学反应方程式:2KMnO4+16HCl(浓)=2KCl+2MmC12+5Cl2↑+8H2O;正确答案:2KMnO4+16HCl(浓)=2KCl+2MmC12+5Cl2↑+8H2O。
(2)制备气体或验证气体的性质实验,在装置连接好,加入药品前要检查装置的气密性,A正确;制备四氯化锡,避免与空气接触,金属锡与氧气反应,SnCl4极易水解,所以用产生的Cl2先充满整套装置,排净装置内的空气,B正确;为了提高原料的利用,需要控制盐酸的滴入速率,不能太快,也不能太慢,C正确;冰水浴冷却效果比自然冷却效果好,因此要用冰水浴冷却,D错误;正确选项D。
(3) SnCl4极易水解,因此要防止空气中水蒸气进入到装置6中,因此A的作用是防止空气中水蒸气进入装置6,除此以外,还能够吸收多余的尾气氯气;所以仪器7放的试剂是碱石灰;正确答案:碱石灰;防止空气中水蒸气进入6中使SnCl4水解;吸收多余氯气防止污染空气。
(4) SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还生成氯化氢气体,遇到空气中的水蒸气,生成盐酸小液滴,看到有大量白雾产生;化学方程式为SnCl4+(x+2)H2O=SuOx·xH2O+4HCl; 正确答案:有大量白雾; SnCl4+(x+2)H2O=SuOx·xH2O+4HCl。
(5) 根据金属活动顺序表,Sn排在H的左边,因此Sn与盐酸反应:Sn+2HCl=SnCl2+H2↑,也有可能发生SnCl4+Sn=2SnCl2;正确答案:Sn+2HCl=SnCl2+H2↑(或SnCl4+Sn=2SnCl2)。
(6) 根据化学反应方程式,当滴入最后一滴KIO3,KIO3把KI氧化成I2,淀粉变蓝,因此滴定到终点现象是:当滴入最后一滴标准液,溶液出现蓝色且半分钟不褪色;根据反应方程式,求出样品中含有m(SnCl2)=0.01×8×10-3×3×190=0.0456 g,样品中含有m(SnCl4)=0.4-0.0456=0.3544 g,产品纯度是0.3544/0.4×100%=88.6%;正确答案:当滴入最后一滴标准液,溶液出现蓝色且半分钟不褪色 ;88.6%。

【题目】下列实验中,对应的现象和结论都正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 常温下,质量和形状相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 某食盐溶液中加入淀粉溶液 | 溶液不变蓝 | 该食盐样品中一定不含KIO3 |
C | SO2通入BaCl2 溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
D | 将少量大理石粉未加入1.0mol/L的NH4Cl 溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
A. A B. B C. C D. D