题目内容
【题目】下列实验中,可以加快反应速率的是( )
A. 锌与稀硫酸反应时,加入少量CuSO4固体
B. 钠与水反应时,增加水的量
C. 用18mol/L的硫酸溶液代替2mol/L硫酸溶液常温下与铝反应
D. 锌与稀硫酸反应时,加入少量醋酸钠固体
【答案】A
【解析】A、锌把铜置换出来,构成原电池,加快反应速率,故A正确;B、纯液体的浓度视为常数,增加水的量,水的浓度不变,反应速率不变,故B错误;C、18mol·L-1H2SO4是浓硫酸,与铝发生钝化反应,因此反应速率减缓,故C错误;D、醋酸是弱酸,硫酸中加入醋酸钠,生成醋酸,溶液c(H+)减少,反应速率降低,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途
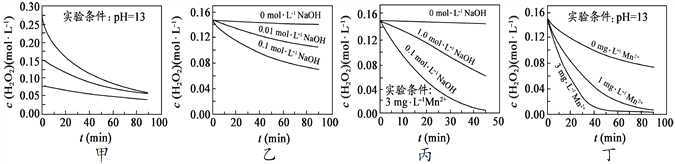
Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:________(填字母序号)
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了____________________(填字母序号)
A.反应速率 B.反应限度C.反应焓变 D.反应路径
E.反应活化能 F.活化分子百分数
Ⅱ. H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
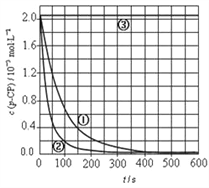
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。
(3)电中性的羟基自由基的电子式为:______________
(4)请完成以下实验设计表(表中不要留空格)。
实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | _________ | ______ | _______ | _________ |
③ | __________________ | 298 | 10 | 6.0 | 0.30 |
(5)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=_____________
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:__________________________。