题目内容
向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,加水稀释,取少量所得溶液,加入少量二氧化锰,又有气体放出,待气体不再放出后,再滴加酚酞,溶液变红。下列猜测不合理的是
| A.过氧化钠和水反应生成氢氧化钠和氧气 |
| B.过氧化钠和水反应的产物是过氧化氢和氧气 |
| C.过氧化氢在二氧化锰催化作用下分解生成氧气和水 |
| D.过氧化钠跟水反应生成氢氧化钠和过氧化氢 |
B
解析试题分析:与水反应实质:Na2O2+2H2O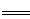 2NaOH+H2O2,生成的双氧水(H2O2)不稳定迅速发生分解(属于氧化一还原反应) 2H2O2
2NaOH+H2O2,生成的双氧水(H2O2)不稳定迅速发生分解(属于氧化一还原反应) 2H2O2 2H2O+O2↑,这也是Na2O2呈现漂白性的本质原因.将两步合并得:2Na2O2+4H2O
2H2O+O2↑,这也是Na2O2呈现漂白性的本质原因.将两步合并得:2Na2O2+4H2O 4NaOH+O2 +2H2O,两边相同的水消去,得到:2Na2O2 + 2H2O
4NaOH+O2 +2H2O,两边相同的水消去,得到:2Na2O2 + 2H2O  4NaOH + O2↑,过氧化钠和过氧化氢氧的化合价都是-1价,化合价没有变,所以不是氧化还原反应,不可能生成氧气,故B错误。
4NaOH + O2↑,过氧化钠和过氧化氢氧的化合价都是-1价,化合价没有变,所以不是氧化还原反应,不可能生成氧气,故B错误。
考点:考查过氧化钠的性质。

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
| A.加热这两种固体物质,并将生成的气体通入澄清的石灰水中 |
| B.在这两种物质的溶液中加入CaCl2溶液 |
| C.在等量的两种固体中加入等体积等浓度的稀盐酸 |
| D.在这两种物质的溶液中加入少量澄清的石灰水 |
海水中含有氯化镁,是镁的重要来源之一。从海水中提取镁,可按照以下步骤进行:
①把贝壳制成石灰乳
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将所得的产物熔融后电解。
关于提取镁,下列说法不正确的是( )
| A.此法的优点之一是原料来源丰富 |
| B.进行①、②、③步操作的目的是从海水中提取氯化镁 |
| C.第④步电解时会产生氯气 |
| D.以上提取镁的过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法正确的是( )
| A.该合金的熔点介于钠、铝之间 |
| B.钠或铝形成的氧化物均为碱性氧化物 |
| C.钠和铝分别与不足量的盐酸反应所得溶液均呈中性 |
| D.若合金中n(Na)>n(Al),将其投入到适量的水中可得无色透明溶液 |
下列说法正确的是( )
| A.金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体 |
| B.铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体 |
| C.过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ |
| D.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
下列除杂所用的方法、试剂或发生的反应错误的是( )。
| A.除去FeCl2中的CuCl2:Fe+Cu2+=Fe2++Cu |
| B.除去Fe中的少量Al,可将固体加入到足量的NaOH溶液中,过滤 |
| C.除去FeCl2中的FeCl3:2Fe3++Fe=3Fe2+ |
| D.除去Fe2O3中的Fe(OH)3,可向混合物中加入足量的盐酸 |
将5.1 g镁铝合金投入到500 mL 2.0 mol/L的盐酸中,金属完全溶解,再加入4.0 mol/L的NaOH溶液,若要生成的沉淀最多,则应加入NaOH溶液的体积是( )
| A.200 mL | B.250 mL | C.425 mL | D.560 mL |
在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
| A.先生成沉淀,后沉淀全部溶解 |
| B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 |
| C.最后得到的沉淀是BaSO4 |
| D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
