题目内容
【题目】下列装置或操作不能达到实验目的是( )
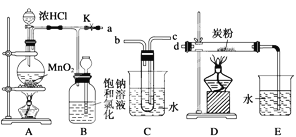
A. 实验室制取并收集
实验室制取并收集![]() B.
B.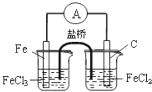 构成原电池
构成原电池
C. 检查装置气密性D.
检查装置气密性D. 实验室制备乙烯
实验室制备乙烯
【答案】B
【解析】
A、氨气比空气轻极易溶于水,收集用向下排空气法收集,多余的氨气需要进行尾气吸收,装置中集气瓶导气管位置符合收集气体要求,尾气吸收可以防倒吸;故A正确;
B、原电池构成条件是活泼性不同的电极,电解质溶液,闭合回路,自发进行的氧化还原反应,盐桥的主要是起到导电作用,防止同种电荷离子间的影响;装置中铁在氯化铁溶液中可以直接发生化学反应,不能构成原电池。应在正极的烧杯中注入氯化铁溶液,负极溶液中可以是氯化亚铁溶液,故B错误;
C、装置气密性检查的依据是依据气体压强的变化和液面的变化判断;装置中关闭止水夹,从长颈漏斗中加入水至一定高度,静置一段时间液面不焓变,证明气密性良好,故C正确;
D、实验制备乙烯利用浓硫酸和乙醇混合加热到170℃发生消去反应生成,温度计测定反应液的温度;故D正确;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________