题目内容
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
B
解析试题分析:金属原子化热是指 1mol 金属变成气态原子所需要的热量,不能用金属原子化热计算Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量,A项错误;氯化钠与晶体硅的晶体类型不同,所以不能用晶格能和共价键的键能来比较,C项错误;微粒半径越大,共价键也越弱,D项错误;C项:△H="176" kJ·mol-1X2+2X243 kJ·mol-1-360 kJ·mol-1X4="-602" kJ·mol-1,B项正确。
考点:本题考查△H的计算及化学键的强弱、晶体熔点的比较。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是
| A.该晶体类型是原子晶体 |
| B.晶体中碳原子数与C—O化学键数之比为1∶2 |
| C.晶体的空间最小环共有12个原子构成 |
| D.该晶体中碳原子和氧原子的个数比为1∶2 |
下列叙述中正确的是
| A.晶体与非晶体的根本区别在于是否具有规则的几何外形 |
| B.晶体具有物理性质各向异性 |
| C.晶体、非晶体均具有固定的熔点 |
| D.由玻璃制成规则的玻璃球体现了晶体的自范性 |
原子晶体干冰具有类似SiO2的晶体结构,下列有关它的推断中,错误的是
| A.它可作耐磨材料 |
| B.它不可用作致冷剂 |
| C.晶体中每个碳原子形成2个碳氧双键 |
| D.晶体中碳、氧原子个数之比为1:2 |
形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
| A.仅①②③ | B.仅②④⑤ |
| C.仅①③ | D.①②③④⑤ |
(8分)选择以下物质填写下列空白:
| A.氢氧化钠 | B.氧化镁 | C.He | D.二氧化硅 |
(1)晶体中存在分子的是 。(2)晶体中既有离子键又有共价键的是 。
(3)融化时需要破坏共价键的是 。(4)最易溶于水的分子晶体是 。
探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
物质的非晶体能自动转变为晶体,而晶体却不能自动地转变为非晶体,这说明( )。
| A.非晶体是不稳定的,处于晶体时能量小 |
| B.晶体是稳定的,处于晶体时能量大 |
| C.非晶体是不稳定的,处于晶体时能量小 |
| D.晶体是不稳定的,处于晶体时能量小 |
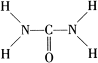 : 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。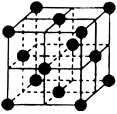
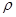 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3