题目内容
10.以下结构中,●代表原子序数从l到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: ).
).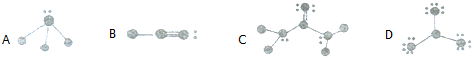
(1)根据各图表示的结构的特点,写出该分子的化学式:
A:NH3,B:HCN,C:CO(NH2)2,D:BF3;
(2)试用上述方法表示NCl3、CO2的分子结构:
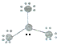 、
、 .
.
分析 根据没有成键的电子数和成键电子数和推知原子的最外层电子数,根据原子序数小于10可知原子的种类,根据结构式可推知化学式.
解答 解:(1)A、氨气中N与H形成三对共价键,剩余一对孤对电对,化学式为:NH3,故答案为:NH3;
B、第一个原子只成一对共价键为H元素,最后一个成三对共价键,剩余一对孤对电子,应为N元素,所以此分子为HCN,故答案为:HCN;
C、中间原子形成4个共价键,没有电子剩余,则其最外层有4个电子,在1-10号元素中只有C,只与C原子形成2个共价键,且有4个剩余电子,该原子为O元素,与C原子形成1个共价键,且与另外原子又形成2个共价键,还剩余1对电子,该原子最外层电子数为5,故为N元素,与N原子相邻的原子只形成一个共价键,没有电子剩余,其最外层只有1个电子,故为H元素,所以C的化学式CO(NH2)2;故答案为:CO(NH2)2;
D、中间原子形成3个共价键,没有电子剩余,则其最外层有3个电子,在1-10号元素中只有B元素,其余原子形成1个共价键,还剩余3对电子,该原子最外层电子数为7,故为F元素,所以D的化学式BF3,故答案为:BF3;
(2)NCl3中N与Cl形成三对共价键,剩余一对电子,Cl剩余三对电子,CO2中C分别与O形成两对共价键,故答案为: 、
、 .
.
点评 本题考查了常见元素的成键特点,题目难度不大,注意把握原子形成的共价键数目与其原子核外的单电子数有关.

练习册系列答案
相关题目
2.25℃时,下列各溶液中,离子的物质的量浓度关系正确的( )
| A. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 氯化铵溶液:c(NH+4)>c(Cl-)>c(H+)>c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
3.两个体积相等的容器,一个盛有CO,另一个盛有N2和O2,在同温同压下两个容器内的气体一定具有相同的( )
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
20.生物学家借助新的显微技术,成功观察到小于200nm的微粒,下列分散系中,分散质微粒半径最小的是( )
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入FeCl3饱和溶液得到的红褐色液体 | |
| D. | 向澄清的石灰水中通入少量二氧化碳气体得到的分散系 |
15.已知N2+3H2$?_{催化剂}^{高温高压}$2NH3属于放热反应,则2NH3?N2+3H3属于( )
| A. | 放热反应 | B. | 吸热反应 | C. | 离子反应 | D. | 不可逆反应 |
2.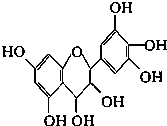 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1mol该物质可与4molBr2反应 | |
| C. | 1mol该物质可与7molNaOH反应 | |
| D. | 1mol该物质可与7molNa反应 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=8的溶液:K+、Fe3+、NO3-、Cl- | |
| B. | 能与Al反应产生H2的溶液:K+、Na+、SO42-、Cl- | |
| C. | 含FeCl3的溶液:K+、NH4+、I-、SCN- | |
| D. | c(OH-)=1×10-13 mol•L-1的溶液:NH4+、Na+、Si32-、CH3COO- |