题目内容
(Ⅰ)用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:
(1)配制稀硫酸时,应选用容量为________mL的容量瓶;
(2)经计算需要用量筒量取_______mL浓硫酸,在量取时宜选用下列量筒中的____(填字母).
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1-2cm处,改用胶头滴管加蒸馏水,使溶液的凹液面底部与瓶颈的环形标线相切。
③将浓硫酸缓缓注入盛适量蒸馏水的烧杯中,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________________。
(4)容量瓶使用之前,检查其是否漏水的具体操作为
。
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓硫酸,其配制的稀硫酸浓度会________(填“偏高”、“偏低”、“无影响”)。
(Ⅱ)某同学称量mgNaOH固体配制V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号) 。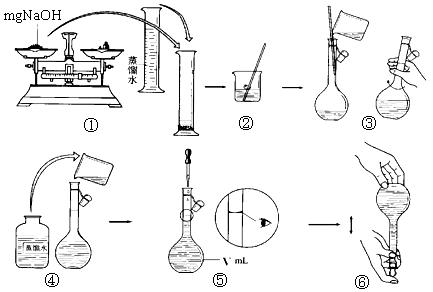
.[(1)~(3)各1分,(4)(5)(Ⅱ)各2分](Ⅰ)(1)250 (2)13.6 C (3)③①④②
(4)用右手食指顶住瓶塞用左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将瓶塞旋转180度,重复上述操作,如果瓶口处仍无水渗出,则此容量瓶不漏水。【注:答‘将容量瓶中加水并倒立看瓶嘴部分是否漏水’即可给2分】 (5)偏低 (Ⅱ)①④⑤
【解析】
试题分析:(Ⅰ)(1)实验室没有220ml的容量瓶,所以需要250ml容量瓶。
(2)稀释过程中溶质不变,所以需要浓硫酸的体积是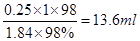 。
。
(3)根据配制的原理以及操作的要求可知,正确的操作顺序是③①④②。
(4)检验容量瓶是否漏水的正确操作要求是用右手食指顶住瓶塞用左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将瓶塞旋转180度,重复上述操作,如果瓶口处仍无水渗出,则此容量瓶不漏水。
(5)用刚刚洗涤洁净的量筒来量取浓硫酸,则相当于稀释了浓硫酸,所以硫酸的物质的量减少,则浓度偏低。
(Ⅱ)氢氧化钠应该放在烧杯中称量,①不正确;向容量瓶中加入蒸馏水时,应该用玻璃棒引流,④错误;定容时应该平视,⑤不正确,所以答案选①④⑤。
考点:考查物质的量浓度溶液的有关配制的有关判断和计算
点评:该题是中等难度的试题,试题基础性强,难易适中。该题的关键是明确配制的原理以及要求,有利于培养学生实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题的难点在于误差分析,学生需要明确的是根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案