题目内容
【题目】将一小块钠投入CuSO4溶液中,观察到的现象是__________(填序号)。
①钠浮于液面上;②熔化成小球;③发出嘶嘶的响声,放出气体;④有蓝色沉淀产生;⑤析出大量红色的铜。用离子方程式解释实验现象__________________________
【答案】①②③④ 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑
、
【解析】
钠投入CuSO4溶液中,钠先与水反应现象为:浮、熔、游、响,①②③正确;钠与水反应生成氢氧化钠和氢气,生成的NaOH与CuSO4反应生成蓝色的Cu(OH)2沉淀,④正确,⑤错误;方程式为:2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2 ↑。

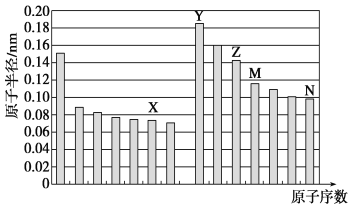
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为_____________________(填化学式)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,写出其化学方程式____。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____________,N→⑥的单质的化学方程式为_____________。
【题目】在四支试管中,在不同条件下发生反应:Fe+2HCl = FeCl2+H2↑,判断产生H2的反应速率最快的是:
试管 | 盐酸浓度 | 温度 | 铁的状态 |
① | 0.5 mol·L-1 | 20 ℃ | 块状 |
② | 0.5 mol·L-1 | 20 ℃ | 粉末状 |
③ | 1 mol·L-1 | 35 ℃ | 块状 |
④ | 2 mol·L-1 | 35 ℃ | 粉末状 |
A. ① B. ② C. ③ D. ④