题目内容
【题目】I.如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:

锌为__极,该电极上发生__反应(“氧化”或“还原”),电极反应式为__,该原电池的总反应离子方程式为__.
II.(1)氮化钠的电子式是_____________。
(2)氮化钠与水反应的化学方程式是__________________。
(3)氮化钠与盐酸反应生成_______种盐。
(4)氮化钠中两种微粒的半径大小比较: r(Na+)___r(N3-)(填“大于”、“小于”或“等于”)。
【答案】 负 氧化 Zn﹣2e﹣=Zn2+ Zn+Cu2+=Zn2++Cu ![]() Na3N+H2O=NH3+3NaOH )两 小于
Na3N+H2O=NH3+3NaOH )两 小于
【解析】I.锌的金属性强于铜,锌为负极,该电极上发生氧化反应,电极反应式为Zn-2e-=Zn2+,正极是银,溶液中铜离子得到电子,该原电池的总反应离子方程式为Zn+Cu2+=Zn2++Cu。
II.(1)氮化钠是离子化合物,电子式是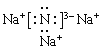 。(2)氮化钠与水反应生成氢氧化钠和氨气,反应的化学方程式是Na3N+H2O=NH3↑+3NaOH。(3)氮化钠与盐酸反应生成氯化铵和氯化钠两种盐。(4)氮化钠中两种微粒的核外电子排布相同,离子半径随原子序数的增大而减小,则 r(Na+)小于r(N3-)。
。(2)氮化钠与水反应生成氢氧化钠和氨气,反应的化学方程式是Na3N+H2O=NH3↑+3NaOH。(3)氮化钠与盐酸反应生成氯化铵和氯化钠两种盐。(4)氮化钠中两种微粒的核外电子排布相同,离子半径随原子序数的增大而减小,则 r(Na+)小于r(N3-)。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
【题目】化学在生活中有着广泛的应用,下列对立关系正确的是( )
选项 | 化学性质 | 实际应用 |
A | SO2具有还原性 | 漂白纸浆 |
B | HF具有弱酸性 | 在玻璃上刻字, |
C | 铝的金属活动性强于氢 | 用铝制容器贮运浓硝酸 |
D | FeCl3溶液能与Cu反应 | 蚀刻铜箔制造电路板 |
A.A
B.B
C.C
D.D
