题目内容
在25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
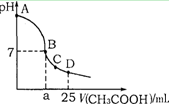

| A.对于曲线上AB间任一点,溶液中都有:c(Na+) >c(CH3COO-)>c(OH-)>c(H+) |
| B.在B点,a>12.5,且有c(Na+) =c(CH3COO-) =c(OH-) =c(H+) |
| C.在C点,c(CH3COO-)-c(Na+) =c(H+)-c(OH-) |
| D.在D点,c(CH3COO-) + c(CH3COOH) =c(Na+) |
C
当加入的醋酸很少时,溶液中c(OH-)可以大于c(CH3COO-)。当醋酸和氢氧化钠恰好反应时,溶液显碱性,此时消耗醋酸的体积是12.5ml。B点显中性,说明醋酸过量,即a>12.5,但c(Na+) =c(CH3COO-) >c(OH-) =c(H+)。C点显酸性,根据电荷守恒可知c(CH3COO-)+c(OH-)=c(H+)+c(Na+),所以选项C 正确。当加入25ml醋酸时,根据原子守恒可知c(CH3COO-) + c(CH3COOH) =2 c(Na+),所以答案是C。

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
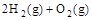 =2H2O(g) △H=△H2
=2H2O(g) △H=△H2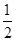 △H2
△H2