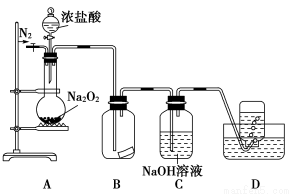
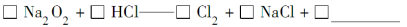ћвƒњƒЏ»Ё
ѕ¬Ѕ–ЋµЈ®’э»Јµƒ «(°°°°)
A£Ѓ»ќЇќЋб”лЉоЈҐ…ъ÷–ЇЌЈі”¶…ъ≥…1 mol H2Oµƒєэ≥ћ÷–£ђƒ№Ѕњ±дїѓЊщѕаЌђ
B£ЃЌђќ¬Ќђ—єѕ¬£ђH2(g)£ЂCl2(g)=2HCl(g)‘Џєв’’ЇЌµг»ЉћхЉюѕ¬µƒ¶§H≤їЌђ
C£Ѓ“—÷™£ЇҐў2H2(g)£ЂO2(g)=2H2O(g) ¶§H£љ£≠a kJ°§mol£≠1£ђ
ҐЏ2H2(g)£ЂO2(g)=2H2O(l) ¶§H£љ£≠b kJ°§mol£≠1£ђ‘тa>b
D£Ѓ“—÷™£ЇҐўC(s£ђ ѓƒЂ)£ЂO2(g)=CO2(g) ¶§H£љ£≠393.5 kJ°§mol£≠1£ђ
ҐЏC(s£ђљрЄ’ ѓ)£ЂO2(g)=CO2(g) ¶§H£љ£≠395.0 kJ°§mol£≠1£ђ
‘тC(s£ђ ѓƒЂ)=C(s£ђљрЄ’ ѓ)°°¶§H£љ£Ђ1.5 kJ°§mol£≠1
°°D
°Њљвќц°њ°°Aѕо£ђЋб°ҐЉо«њ»х≤їЌђ£ђЈі”¶єэ≥ћµƒƒ№Ѕњ±дїѓ≤їЌђ£їBѕо£ђЈі”¶µƒ¶§H”лЈі”¶ћхЉюќёєЎ£їCѕо£ђa<b£їDѕо£ђјы”√Ґў£≠ҐЏњ…µ√°£

“їґ®ќ¬ґ»ѕ¬£ђ‘Џƒ≥2 LЇг»Ё√№±’»Ё∆ч÷–Љ”»лƒ…√„ЉґCu2O≤ҐЌ®»л0.1 mol H2O(g)£ђЈҐ…ъЈі”¶£Ї2H2O(g)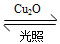 2H2(g)£ЂO2(g)°°¶§H£љ£Ђ484 kJ°§mol£≠1£ђ≤їЌђ ±Љд≤ъ…ъO2µƒќп÷ µƒЅњЉыѕ¬±н£Ї
2H2(g)£ЂO2(g)°°¶§H£љ£Ђ484 kJ°§mol£≠1£ђ≤їЌђ ±Љд≤ъ…ъO2µƒќп÷ µƒЅњЉыѕ¬±н£Ї
±Љд/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
ѕ¬Ѕ–ЋµЈ®’э»Јµƒ «(°°°°)
A£Ѓіпµљ∆љЇв ±£ђ–и“™і”Ќвљзќь ’µƒƒ№Ѕњќ™0.968 kJ
B£Ѓ«∞20 minƒЏµƒ∆љЊщЈі”¶Ћў¬ v(H2O)£љ2.5°Ѕ10£≠5mol°§L£≠1°§min£≠1
C£Ѓ‘ціуc(H2O)£ђњ…“‘ћбЄяЋЃµƒЈ÷љв¬
D£Ѓ є”√њ≈Ѕ£Єь–°µƒƒ…√„ЉґCu2O£ђњ…“‘‘ціу∆љЇв ±O2µƒћеїэЈ÷ э