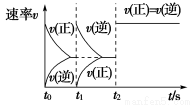
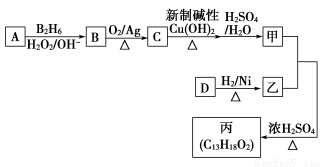
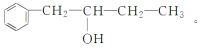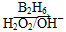题目内容
一定温度下,在某2 L恒容密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)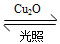 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法正确的是( )
A.达到平衡时,需要从外界吸收的能量为0.968 kJ
B.前20 min内的平均反应速率v(H2O)=2.5×10-5mol·L-1·min-1
C.增大c(H2O),可以提高水的分解率
D.使用颗粒更小的纳米级Cu2O,可以增大平衡时O2的体积分数
A
【解析】 根据表中信息知,达平衡时生成的n(O2)=0.002 0 mol,则达平衡时吸收的热量是484 kJ·mol-1×0.002 0 mol=0.968 kJ,A项正确;B项,v(O2)=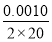 =2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误 ;催化剂只能加快反应速率,不能使平衡移动,D项错误。
=2.5×10-5 mol·L-1·min-1,则 v(H2O)=2v(O2)=5×10-5 mol·L-1·min-1,B项错误;增大H2O的浓度,H2O的转化率降低,C项错误 ;催化剂只能加快反应速率,不能使平衡移动,D项错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目