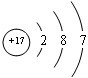
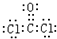题目内容
(2012?醴陵市模拟)已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C).其中正确的是( )
分析:A、NaHSO3溶液呈酸性说明亚硫酸氢离子电离大于水解、NaHCO3溶液呈碱性说明碳酸氢根离子水解大于电离;
B、依据溶液中电荷守恒分析判断;
C、依据物料守恒计算判断;
D、溶液中电离和水解程度不同,离子浓度不同;
B、依据溶液中电荷守恒分析判断;
C、依据物料守恒计算判断;
D、溶液中电离和水解程度不同,离子浓度不同;
解答:解:A、NaHSO3溶液呈酸性说明亚硫酸氢离子电离大于水解、溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-);NaHCO3溶液呈碱性说明碳酸氢根离子水解大于电离,液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(SO32-)>c(H+),故A错误;
B、溶液中存在电荷守恒为:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C、依据电荷守恒,c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),物料守恒得到c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),合并得到:c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
故C正确;
D、溶液中电离和水解程度不同,离子浓度不同,故D错误;
故选C.
B、溶液中存在电荷守恒为:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C、依据电荷守恒,c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),物料守恒得到c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),合并得到:c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
故C正确;
D、溶液中电离和水解程度不同,离子浓度不同,故D错误;
故选C.
点评:本题考查了溶液中电荷守恒,离子浓度大小比较,物料守恒的计算应用,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
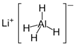 )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )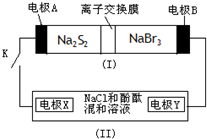 (2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
(2012?醴陵市模拟)如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为: