题目内容
15. 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.(1)基态硅原子的电子排布式:1s22s22p63s23p2.
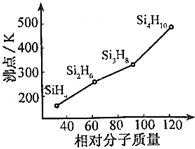
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷的通式为SinH2n+2,硅烷中硅采取sp3杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是硅烷的相对分子质量越大,分子间范德华力越强.
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为As<Se<Br.(用元素符号表示)
(4)气态SeO3分子的立体构型为平面三角形,与SeO3互为等电子体的一种离子为CO32-或NO3-(填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为1:3;若该晶体的晶胞棱长为a pm,则该合金密度为$\frac{\frac{197+64×3}{N{\;}_{A}}}{(a×10{\;}^{-10}){\;}^{3}}$g/cm3.(列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
分析 (1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2,又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;根据SinH2n+2都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,据此答题;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性呈增大趋势,故电负性Br>Se>As,据此答题;
(4)气态SeO3分子中中心原子的价层电子对数可以判断分子构型;根据等电子体要求原子总数相同,价电子数相同来确定;
(5)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2,又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强,故答案为:SinH2n+2;sp3;硅烷的相对分子质量越大,分子间范德华力越强;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性呈增大趋势,故电负性As<Se<Br,故答案为:As<Se<Br;
(4)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32-或NO3-;故答案为:平面三角形;CO32-或NO3-;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{\frac{197+64×3}{N{\;}_{A}}}{(a×10{\;}^{-10}){\;}^{3}}$g•cm-3,
故答案为:1:3;$\frac{\frac{197+64×3}{N{\;}_{A}}}{(a×10{\;}^{-10}){\;}^{3}}$.
点评 本题主要考查了核外电子排布、第一电离能、分子空间构型、杂化方式、晶胞密度的计算,难度中等,解题时要注意对基本知识的灵活运用.

 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 蓝矾结晶水测定实验中,用坩埚钳取下坩埚放置在桌面上冷却 | |
| B. | 用试管夹夹持试管加热时,用手紧紧握住试管夹的长柄和短柄 | |
| C. | 测定中和反应的反应热时,将NaOH溶液一次性倒入盐酸中,并用环形玻璃搅拌棒搅动溶液 | |
| D. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取→蒸馏 |
| A. | 实验室中可以用生石灰与浓氨水混合的方法制取少量氨气 | |
| B. | 酸碱滴定实验中,滴定管装液前应用待装溶液润洗,锥形瓶不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的3/4 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CaSO3是难溶物 | 向CaCl2溶液中通入SO2产生白色沉淀 |
| B | 明矾能水解生成Al(OH)3胶体 | 实验室用明矾与水反应制Al(OH)3 |
| C | SiO2是酸性氧化物 | SiO2与任何酸均不反应 |
| D | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 纯碱溶液清洗油污,加热可增强其去污能力 | |
| B. | 门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料 | |
| C. | 聚丙烯酸钠是一种高吸水性树脂 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
| A. | 反应中硫酸作氧化剂 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 |
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |