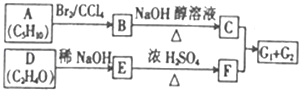
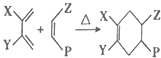题目内容
【题目】将浓度为0.1molL﹣1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.![]()
D.![]()
【答案】D
【解析】解:A、因HF为弱酸,则浓度为0.1molL﹣1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误; B、因电离平衡常数只与温度有关,则Ka(HF)在稀释过程中不变,故B错误;
C、因稀释时一段时间电离产生等量的H+和F﹣ , 溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10﹣7molL﹣1 , c(F﹣)不断减小,则比值变小,故C错误;
D、因Ka(HF)= ![]() ,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则
,当HF溶液加水不断稀释,促进电离,c(F﹣)不断减小,Ka(HF)不变,则 ![]() 增大,故D正确;
增大,故D正确;
故选:D.
根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某学习小组以Ba(OH)2、水、H2SO4为实验对象探究离子反应发生的条件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化 | |
| ① Ba(OH)2粉末:灯泡不亮 ② 加入蒸馏水:灯泡变亮 ③ 逐滴滴加0.1 mol/L H2SO4,灯泡变化如下: |
(1)Ba(OH)2与H2SO4在溶液中能发生_________反应。
a. 复分解反应 b. 氧化还原反应 c. 置换反应
(2)加H2O后,灯泡变亮的原因是Ba(OH)2发生了___________。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因_________。
(4)查阅有关物质溶解度数据如下表:
物质 | Ba(OH)2 | BaSO4 |
溶解度/g | 5.6 | 0.00025 |
比较溶液1、溶液2中c (SO42- )的大小: > ___________
(5)实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。
① Na2SO4溶液的浓度是_________。
② 加入Na2SO4溶液过程中灯泡不熄灭,原因是_________。
通过实验可知:离子反应发生的条件之一是生成沉淀。