题目内容
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙).
请回答下列问题:
(1)B的原子结构示意图______;E在周期表中的位置是______.
(2)C、D、E三种原子对应的离子半径由大到小的顺序是______(填具体离子);甲、乙两种化合物所含的化学键都属于______.
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,产生的气体可充填气球,该反应的化学方程式为:______.
(4)在100mL 18mol/L的浓的A、C、E组成酸溶液中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______;(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为:______.
(5)经检测,某固体粉末中仅含有C和D两种元素组成的化合物,请设计简单的实验方案探究该固体粉末的成分:______.
解:A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为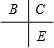 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,
(1)B为N元素,其原子结构示意图为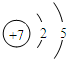 ,E为S,位于元素周期表中的第三周期ⅥA族,故答案为:
,E为S,位于元素周期表中的第三周期ⅥA族,故答案为: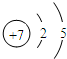 ;第三周期ⅥA族;
;第三周期ⅥA族;
(2)电子层越多,离子半径越大,具有相同电子层的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+,甲为H2O,乙为H2O2,则甲、乙两种化合物所含的化学键都属于共价键,故答案为:S2->O2->Na+;共价键;
(3)金属易拉罐含有金属铝,A、C、D组成的化合物为NaOH,铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlOH2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)100mL 18mol/L的浓的A、C、E组成酸溶液中加入过量的铜,发生Cu与浓硫酸的反应,若硫酸完全反应,生成二氧化硫为硫酸物质的量的一半,则气体体积最大为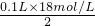 ×22.4L/mol=20.16L,但随反应的进行,稀硫酸不与Cu反应,则生成的气体少于20.16L,ab均可能;硝酸盐在酸性条件下具有硝酸的强氧化性,则上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
×22.4L/mol=20.16L,但随反应的进行,稀硫酸不与Cu反应,则生成的气体少于20.16L,ab均可能;硝酸盐在酸性条件下具有硝酸的强氧化性,则上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:ab;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)C为氧元素,D为钠元素,两种元素组成的化合物为氧化钠、过氧化钠.该固体粉末可能的组成为Na2O、Na2O2或两者的混合物.将粉末加入水中,若无气体生成,则为Na2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物,
故答案为:该固体粉末可能的组成为Na2O、Na2O2或两者的混合物.将粉末加入水中,若无气体生成,则为Na2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物.
分析:A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为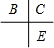 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,然后结合元素化合物知识及化学用语来解答.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,然后结合元素化合物知识及化学用语来解答.
点评:本题考查无机物的推断及结构与位置关系,涉及常用化学用语,盐类水解、氧化还原反应、实验方案设计等,题目难度中等,是对知识综合运用与学生能力考查,推断元素是关键,较好的体现学生充分利用信息,对知识全面掌握的情况.
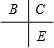 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,(1)B为N元素,其原子结构示意图为
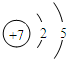 ,E为S,位于元素周期表中的第三周期ⅥA族,故答案为:
,E为S,位于元素周期表中的第三周期ⅥA族,故答案为: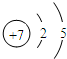 ;第三周期ⅥA族;
;第三周期ⅥA族;(2)电子层越多,离子半径越大,具有相同电子层的离子,原子序数大的离子半径小,则离子半径为S2->O2->Na+,甲为H2O,乙为H2O2,则甲、乙两种化合物所含的化学键都属于共价键,故答案为:S2->O2->Na+;共价键;
(3)金属易拉罐含有金属铝,A、C、D组成的化合物为NaOH,铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为2Al+2OH-+2H2O=2AlOH2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)100mL 18mol/L的浓的A、C、E组成酸溶液中加入过量的铜,发生Cu与浓硫酸的反应,若硫酸完全反应,生成二氧化硫为硫酸物质的量的一半,则气体体积最大为
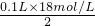 ×22.4L/mol=20.16L,但随反应的进行,稀硫酸不与Cu反应,则生成的气体少于20.16L,ab均可能;硝酸盐在酸性条件下具有硝酸的强氧化性,则上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
×22.4L/mol=20.16L,但随反应的进行,稀硫酸不与Cu反应,则生成的气体少于20.16L,ab均可能;硝酸盐在酸性条件下具有硝酸的强氧化性,则上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:ab;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)C为氧元素,D为钠元素,两种元素组成的化合物为氧化钠、过氧化钠.该固体粉末可能的组成为Na2O、Na2O2或两者的混合物.将粉末加入水中,若无气体生成,则为Na2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物,
故答案为:该固体粉末可能的组成为Na2O、Na2O2或两者的混合物.将粉末加入水中,若无气体生成,则为Na2O;若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物.
分析:A、B、C、D、E为原子序数依次增大的五种短周期元素,C与B、E在周期表中相邻,且C、E同主族,原子序数C大于A、B小于E,则C处于第二周期,E处于第三周期,所以B、C、E在周期表中的位置关系为
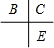 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,然后结合元素化合物知识及化学用语来解答.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含一种金属元素,D应为金属,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,若D为钠元素,则A为氢元素,B为氮元素,C为氧元素,E为硫元素,A和C可形成化合物H2O、H2O2,(相对分子质量H2O<H2O2),符合题意.若D为铝元素,则A为硼元素,B为氧元素,C为氟元素,E为氯元素,A和C形成化合物,不符合题意.故A为氢元素,B为氮元素,C为氧元素,D为钠元素,E为硫元素;甲为H2O;乙为H2O2,然后结合元素化合物知识及化学用语来解答.点评:本题考查无机物的推断及结构与位置关系,涉及常用化学用语,盐类水解、氧化还原反应、实验方案设计等,题目难度中等,是对知识综合运用与学生能力考查,推断元素是关键,较好的体现学生充分利用信息,对知识全面掌握的情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

