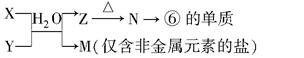题目内容
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
(1)Si3N4(2分);
 (2分)
(2分)
(2)AlN+ NaOH +H2O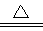 NaAlO2 + NH3↑(2分)
NaAlO2 + NH3↑(2分)
(3)2AlO2-+CO2+3H2O 2Al(OH)3+CO32-(2分)
2Al(OH)3+CO32-(2分)
(4)Fe2O3 +2NH3 2Fe +N2 +3H2O(2分) , 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分)
2Fe +N2 +3H2O(2分) , 取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分,其他合理答案也给分)
(5)3SiO2 +2N2 +6C Si3N4 +6CO(2分)
Si3N4 +6CO(2分)
解析试题分析:丙在标准状况下的密度为0.76g·L-1,根据M= =0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
=0.76g·L-1×22.4L·mol-1≈17g·mol-1,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
(1)根据以上分析可知,乙的化学式为:Si3N4;丙为氨气,氨气为共价化合物,氨气的电子式为: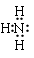 ;
;
(2)甲为AlN,AlN与NaOH浓溶液共热生成了氨气和偏铝酸钠,反应的化学方程式为:AlN+NaOH+H2O NaAlO2+NH3↑;
NaAlO2+NH3↑;
(3)丁溶液为偏铝酸钠溶液,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:2AlO2-+3H2O+CO2 2Al(OH)3↓+CO32-;
2Al(OH)3↓+CO32-;
(4)丙为氨气,X的单质为氮气,高温条件下,氨气与Fe2O3反应生成Fe和氮气单质,反应的化学方程式为:2NH3+Fe2O3 2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
2Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(5)X的单质为N2,Z的氧化物为SiO2,工业上在N2的气氛下将Z的氧化物SiO2和焦炭加热到1400℃~1450℃的条件下以制备乙,乙为Si3N4,反应中还生成一种常见的可燃性气体戊,根据原子守恒,可燃性气体中含有C,所以为CO,该反应的化学方程式为:SiO2+2N2+6C Si3N4+6CO。
Si3N4+6CO。
考点:本题考查无机物的推断,题目难度较大,试题涉及了化学式、电子式的书写、化学方程式、离子方程式的书写、亚铁离子的检验等知识。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案下列叙述正确的是
| A.钠在空气中燃烧生成淡黄色的Na2O2 |
| B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀 |
| C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色 |
| D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭 |
下列实验过程中会先产生白色沉淀后沉淀又溶解的是( )
| A.向AlCl3溶液中滴加氨水至过量 |
| B.向Ba(NO3)2溶液通入SO2至过量 |
| C.向Ba(0H)2溶液通入CO2至过量 |
| D.向新制Fe(OH)3胶体中滴加稀硫酸至过量 |