题目内容
【题目】取2.3g金属钠投入到100g水中,所得溶液的密度为1.022g/cm3。
(1)写出钠与水反应的化学方程式并标出电子转移的方向和数目;_________。
(2)该反应的还原剂是____________,还原产物是______________。
(3)求反应后产生的气体在标准状况下的体积和所得溶液的物质的量浓度。______________。
【答案】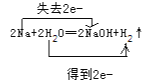 钠 氢气 1.12L;1mol·L-1
钠 氢气 1.12L;1mol·L-1
【解析】
钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑,反应中,钠元素化合价升高,被氧化,Na为反应的还原剂,氢氧化钠为氧化产物,氢元素化合价降低,被还原,H2O为氧化剂,H2为还原产物。
(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑,反应中钠为还原剂,水为氧化剂,反应中转移2e-,则用双线桥表示出电子的转移方向和数目为 ;
;
(2)反应中,钠元素化合价升高,被氧化,Na为反应的还原剂,氢氧化钠为氧化产物,氢元素化合价降低,被还原,H2O为氧化剂,H2为还原产物,故答案为:钠;氢气;
(3)2.3g金属钠的物质的量为![]() =0.1mol,由化学方程式可知,反应生成氢气的物质的量为0.05mol,则标准状况下氢气的体积为0.05mol×22.4L/mol=1.12L;反应生成氢氧化钠的物质的量为0.1mol,由质量守恒定律可知反应后溶液的质量为(2.3g+100g—0.05mol×2g/mol)=102.2g,溶液的体积为
=0.1mol,由化学方程式可知,反应生成氢气的物质的量为0.05mol,则标准状况下氢气的体积为0.05mol×22.4L/mol=1.12L;反应生成氢氧化钠的物质的量为0.1mol,由质量守恒定律可知反应后溶液的质量为(2.3g+100g—0.05mol×2g/mol)=102.2g,溶液的体积为![]() ×10—3L/cm3=0.1L,则所得氢氧化钠溶液的物质的量浓度为
×10—3L/cm3=0.1L,则所得氢氧化钠溶液的物质的量浓度为![]() =1mol/L,故答案为:11.2L;1mol/L。
=1mol/L,故答案为:11.2L;1mol/L。

【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行