题目内容
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子(
 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
(1) 154 (2) 154b/22.4 154a/44.8
(3) 2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1
(3) 2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1
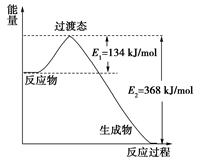
反应热ΔH=反应物的键能之和—产物的键能之和
(1)ΔH=2×2×364+2×522—3×266—2×2×464=—Q,可知Q=154
(2)2H2S(g)+SO2(g)=3S(s)+2H2O(l)
当a>2b时,H2S过量,以SO2的量进行计算,反应放热为: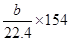 kJ·mol-1;
kJ·mol-1;
当a<2b时,SO2过量,以H2S的量进行计算,反应放热为: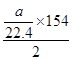 =154a/44.8kJ·mol-1;
=154a/44.8kJ·mol-1;
(3)反应①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-154 kJ·mol-1
反应②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
由盖斯定律①+2×②可知:2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1
(1)ΔH=2×2×364+2×522—3×266—2×2×464=—Q,可知Q=154
(2)2H2S(g)+SO2(g)=3S(s)+2H2O(l)
当a>2b时,H2S过量,以SO2的量进行计算,反应放热为:
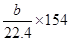 kJ·mol-1;
kJ·mol-1;当a<2b时,SO2过量,以H2S的量进行计算,反应放热为:
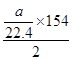 =154a/44.8kJ·mol-1;
=154a/44.8kJ·mol-1;(3)反应①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-154 kJ·mol-1
反应②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
由盖斯定律①+2×②可知:2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1

练习册系列答案
相关题目
 TiCl4
TiCl4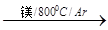 Ti
Ti  Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,
Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,
 方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解吸热
方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解吸热