题目内容
【题目】用1L 0.1mol·L-1NaOH溶液吸收0.07molCO2,所得溶液中n(Na2CO3)和n(NaHCO3)之比约为
A. 3︰4 B. 3︰1 C. 2︰3 D. 3︰2
【答案】A
【解析】
当CO2连续通入NaOH溶液中依次发生两个反应:2NaOH+CO2=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3。1L 0.1mol·L-1NaOH溶液中含有NaOH的物质的量=1L×0.1mol/L=0.1mol:
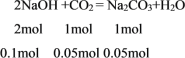
0.1molNaOH消耗0.05molCO2恰好生成0.05molNa2CO3,剩余CO2的物质的量=0.07mol-0.05mol=0.02mol,CO2继续与Na2CO3反应:
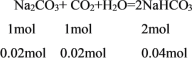
又消耗0.02molNa2CO3,生成0.04molNaHCO3,所得溶液中含有Na2CO3的物质的量=0.05mol-0.02mol=0.03mol。所以所得溶液中n(Na2CO3):n(NaHCO3)=0.03mol:0.04mol=3:4,答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
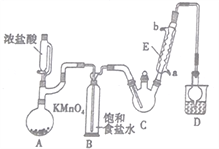
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________,引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70℃左右。
(5)装置D干燥管的作用为_______________,装置D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。
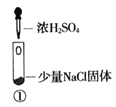
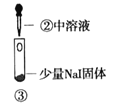
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质