题目内容
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(1)0 (2)0.125
试题分析:(1)因为铜全部溶解,因此溶液中铜离子的物质的量为0.1 mol,那么与铜离子相结合的硝酸根离子的物质的量为0.2 mol。又因为溶液中总的硝酸根离子的物质的量为0.3 mol,所以以硝酸形式存在的离子的物质的量为0.1 mol,也可以理解为溶液中剩余硝酸的物质的量为0.1 mol,那么硝酸的浓度为1mol·L-1,所以其pH=0。(2)若a=9,则题中所提供的硝酸总的物质的量为0.45 mol,减去剩余的0.3mol,那么被还原的硝酸的物质的量为0.15 mol。因为这是一个氧化还原反应,氧化剂所得到的电子与还原剂所失去的电子的物质的量相等,还原剂铜所失去的电子一定为0.2mol,假设反应中生成的二氧化氮的物质的量为x mol, 那么一氧化氮的物质的量就为:(0.15-x)mol,如是有如下关系:
0.2=(0.15-x)×3+x,解之得:x="0.125" mol

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 mol
mol mol
mol L
L +
+ CO2(g)+C(s)可自发进行,则该反应的△H>0
CO2(g)+C(s)可自发进行,则该反应的△H>0 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。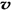 (N2)/
(N2)/ 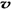 (O2)=2:3
(O2)=2:3 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。