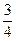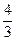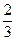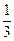题目内容
将一定量的Na2CO3和NaHCO3混合物跟足量的盐酸反应,共消耗HCl 0.8 mol,生成CO2在标准状况下的体积为11.2 L,求原混合物中碳酸钠、碳酸氢钠的质量各是多少。
Na2CO3:31.8 g;NaHCO3:16.8 g
设原混合物中Na2CO3、NaHCO3的物质的量分别为x、y。
由Na2CO3+2HCl 2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑
1 2 1
x 2x x
NaHCO3+HCl NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
1 1 1
y y y
于是有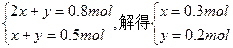
Na2CO3:106 g·mol-1×0.3 mol="31.8" g
NaHCO3:84 g·mol-1×0.2 mol="16.8" g
由Na2CO3+2HCl
 2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑1 2 1
x 2x x
NaHCO3+HCl
 NaCl+H2O+CO2↑
NaCl+H2O+CO2↑1 1 1
y y y
于是有
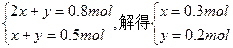
Na2CO3:106 g·mol-1×0.3 mol="31.8" g
NaHCO3:84 g·mol-1×0.2 mol="16.8" g

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目