题目内容
【题目】已知常温常压下,N2(g)+3H2(g)![]() 2NH3 (g) ΔH=-92.4 kJ/mol。在同温同压下向一密闭容器中通入0.5 mol N2和1.5 mol H2,反应完成时放出热量为Q kJ,则下列关系正确的是( )
2NH3 (g) ΔH=-92.4 kJ/mol。在同温同压下向一密闭容器中通入0.5 mol N2和1.5 mol H2,反应完成时放出热量为Q kJ,则下列关系正确的是( )
A. Q=92.4 B. Q=46.2 C. Q<46.2 D. Q>46.2
【答案】C
【解析】
合成氨的反应是可逆反应,反应物不能完全反应;假定完全反应计算放出的热量,实际放出的热量小于完全反应计算放出的热量。
假定0.5molN2和1.5molH2完全反应,根据N2(g)+3H2(g)2NH3(g) △H=-92.4kJ·mol-1可知,放出的热量为:92.4kJ×0.5/1=46.2 kJ,由于合成氨是可逆反应,故反应物不能完全反应,所以放出的热量小于46.2kJ,即Q<46.2 kJ,C正确;
综上所述,本题选C。

【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
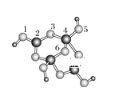
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .