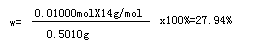题目内容
| |||||||||||
解析:
(1) |
解:NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl 20.00 mLB溶液消耗0.1000mol·L-1NaOH 30.00 mL. 20.00 mLB溶液中过量的HCl:n(HCl)=0.003000 mol , 100 mLB溶液中过量的HCl:n(HCl)=0.01500 mol那么与NH3反应的n(HCl)=0.01000 mol 故0.5010 g样品中n(NH3)=0.01000 mol n(N)=0.01000 mol [Co(NH3)xCly]Clz中氮元素的质量分数
|
(2) |
解:I2+2Na2S2O3==2NaI+Na2S4O6 因反应用去0.1000 mol·L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000 mol Co与Fe同一族,Com+具有强氧化性,故设m=3 则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000 mol 0.5010g样品中Cl的总质量为: m(Cl)=0.5010 g-0.002000 molx59 g·mol-1-0.01000 molx17 g·mol-1=0.2130 g n(Cl)=0.006000 mol 又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓ 0.2505g样品扩大一倍来算(即用0.5010g)推算出: 反应消耗AgNO3:n(AgNO3)=0.1000mol·L-1x40.00mL=0.004000mol 即发生上述反应的Cl-为:n(Cl-)=0.004000mol 则有y:z=(0.006000 mol-0.004000 mol):0.004000mol=1:2 同时还有:1:x:(y+z)=0.002000:0.01000:0.006000=1:5:3 解得:x=5 y=1 z=2 带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3假设成立 该钴化合物的化学式为:[Co(NH3)5Cl]Cl2 答:该钴化合物的化学式为:[Co(NH3)5Cl]Cl2 |

(12分)氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、
Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
[Co (N3)(NH3)5]SO4中钴的配位数为 ,CN—中C原子的杂化类型是 。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,则该异构体是 (填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |