题目内容
【题目】有关如图装置的叙述不正确的是 ( )
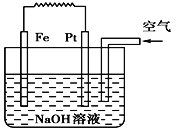
A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
【答案】A
【解析】
该原电池中,铁发生吸氧腐蚀,铁易失电子作负极、铂丝作正极,负极上电极反应式为Fe-2e-+2OH-═Fe(OH)2,正极电极反应式为O2+2H2O+4e-═4OH-,再结合物质性质分析解答。
A、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,选项A不正确;B、该装置中Pt作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,选项B正确;C、该装置中Fe为负极,在NaOH溶液中电极反应为:Fe-2e-+2OH-═Fe(OH)2,选项C正确;D、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,选项D正确;答案选A。

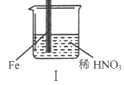
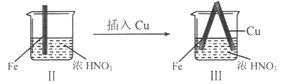
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是___________。
(2)用电子式表示E2F的形成过程____________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_________>_________>_________。
(4)下列实验操作对应的实验现象中,不正确的是_________(填字母)。
选项 | 实验操作 | 实验现象 |
a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 下层溶液变为橙色 |
d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |
(5)写出A与B形成的10电子分子的化学式_________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________(填字母)。

(6)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2 g。下列说法正确的是_________(填字母)。
a m1大于m2 b m1等于m2
c 剩余溶液中一定有Fe3+ d 剩余金属中一定有Cu