题目内容
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体 PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.0500 mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品 中残留磷化物的质量以判断是否合格。
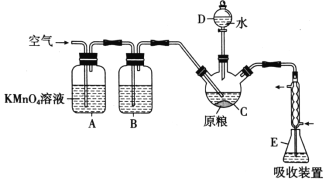
在C中加入100g原粮,E中加入20.00 mL 2.50×10-4 mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器C的名称是___________。
(2)A中酸性高锰酸钾溶液的作用是___________通入空气的作用是______________________。
(3)PH3也可被NaClO氧化可用于制备NaH2PO2,制得的NaH2PO2和NiCl2溶液可用于化学镀镍, 同时生成磷酸和氯化物,请写出化学镀镍的化学方程式为______________________________。
(4)装置E中PH3被氧化成磷酸,充分反应后的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液 20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则滴定终点的现象为______________________________________________。
该原粮样品中磷化物(以PH3计)的残留量为__________________mg/kg。(保留三位有效数字)。
【答案】![]() 三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
【解析】
(1)根据P、H原子结构,分析书写出PH3的电子式;结合示意图辨析仪器;
(2)根据酸性高锰酸钾溶液具有强氧化性分析;根据PH3是气体,滞留在装置中会影响粮食中残留磷化物含量的测定分析;
(3)根据电子得失守恒分析解答;
(4)根据KMnO4溶液的颜色判断,根据氧化还原反应中电子守恒计算。
(1)由于P、H两元素通过共价键结合形成化合物,H原子核外只有一个电子,只能形成一对共用电子对;P原子最外层有5个电子,可结合3个H原子形成三对共用电子对,达到8电子的稳定结构,PH3的电子式是![]() ;由示意图可知仪器C的名称是三颈烧瓶;
;由示意图可知仪器C的名称是三颈烧瓶;
(2)由于空气中也含有还原性气体会干扰后续的实验,因此A中酸性高锰酸钾溶液的作用是吸收空气中的还原性气体,以免使测定结果偏高;AlP与水发生反应产生Al(OH)3和PH3,PH3是气体,会有一部分滞留在三颈烧瓶上部空间内,若通入空气,就可以将三颈烧瓶中空气内的PH3全部赶到E内,被装置E中的酸性KMnO4溶液吸收,以减小实验误差;
(3)NaH2PO2和NiCl2溶液可用于化学镀镍,同时生成磷酸和氯化物,反应中Ni元素化合价从+2价降低到0价,P元素化合价从+1价升高到+5价,所以根据电子得失守恒可知化学镀镍的化学方程式为2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl。
(4)由于酸性高锰酸钾溶液显紫色,则滴定终点的现象为滴入最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色;根据题意可知KMnO4得到电子的物质的量与PH3、Na2SO3失去的电子的物质的量相等,2n(Na2SO3)+8n(PH3)=5n(KMnO4),带入数值:2×10×4.0×10-5mol/L×0.02L+8 n(PH3)=5×2.50×10-4mol/L×0.02L,解得n(PH3)=1.125×10-6mol,m(PH3)=1.125×10-6mol×34g/mol=3.825×10-5g=0.03825mg;则该原粮样品中磷化物(以PH3计)的残留量为0.03825mg÷0.1kg=0.383mg/kg。

【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅥⅠA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)表中能形成两性氢氧化物的元素是______(用元素符号表示),写出该元素与⑨最高价氧化物的水化物反应的化方程式______。
(3)用电子式表示④元素与⑦元素形成化合物的过程______。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是______(填化 学式)。
(5)②的气态氢化物与最高价氧化物对应的水化物反应的离子方程式______。
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)