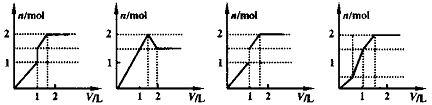
题目内容
(7分)现有含1mol Fe3+和1molAl3+的混合溶液,按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
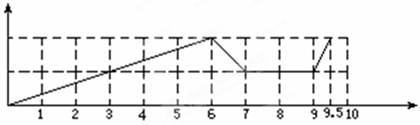
(1)请画出沉淀的物质的量随反应的变化曲线
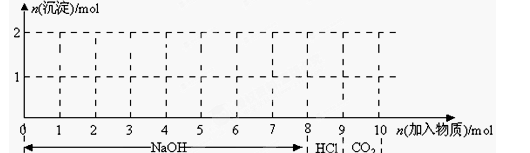
(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。
(1)请画出沉淀的物质的量随反应的变化曲线

(2)逐步写出:6-7、9-10反应的离子方程式:____________________________________。
(1)(4分)
(2)Al(OH)3+OH-=AlO2-+2H2O;
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32- CO2+ CO32-+H2O=2HCO3-

(2)Al(OH)3+OH-=AlO2-+2H2O;
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32- CO2+ CO32-+H2O=2HCO3-
根据试剂可知,反应的方程式先后为Fe3++3OH-=Fe(OH)3、Al3++3OH-=Al(OH)3,此时消耗氢氧化钠是6mol。则继续加入氢氧化钠,氢氧化铝溶解,方程式为Al(OH)3+OH-=AlO2-+2H2O。所以此时加入的2mol氢氧化钠,剩余1mol。因此加入盐酸,首先中和剩余的氢氧化钠,需要1mol盐酸。如果此时通入CO2,则CO2和偏铝酸钠反应生成氢氧化铝沉淀,方程式为CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,消耗CO2是0.5mol。则另外0.5molCO2和生成的碳酸钠反应,生成碳酸氢钠,方程式为CO2+ CO32-+H2O=2HCO3-。

练习册系列答案
相关题目