��Ŀ����
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������A�ĺ����������������Ӳ�����ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3����d��cͬ���壬e�������ֻ��1�����ӣ����������18�����ӡ��ش��������⣺
��1��b��c��d�е�һ������������ ����Ԫ�ط��ţ���e�ļ۲���ӹ��ʾ��ͼΪ ��
��2��a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ �������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ������� ���ѧʽ��д���֣���
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������ ������������ṹ������ �����ѧʽ��
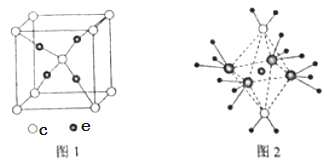
��4��c��e�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1����e���ӵĵ��Ϊ ��
��5����5��Ԫ���γɵ�һ��1:1�����ӻ������У������ӳ�������ṹ�������ӳ����������İ�����ṹ����ͼ2��ʾ�����û�������������Ϊ ���������д��ڵĻ�ѧ�������� ���û��������ʱ����ʧȥ������� ���ж������� ��
���𰸡���1��N![]()
��2��sp3H2O2��N2H4
��3��HNO2��HNO3H2SO3��4��+1
��5��SO42�����ۼ�����λ�� H2O H2O��Cu2������λ����NH3��Cu2������
��������������������ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ����a��HԪ�أ� c������������Ϊ���ڲ��������3����ԭ��������������8������C��OԪ�أ�d��cͬ�壬��d��SԪ�أ� b�ļ۵��Ӳ��е�δ�ɶԵ�����3������ԭ������С��c����b��NԪ�أ� e�������ֻ��һ�����ӣ����������18�����ӣ���e��CuԪ�أ���1��b��c��d�ֱ���N��O��SԪ���У�Ԫ�صķǽ�����Խǿ�����һ������Խ��ͬһ����Ԫ���У���һ����������ԭ��������������������ƣ�����VA��Ԫ�ش�������Ԫ�أ�����N��O��S�е�һ������������NԪ�أ�e�ļ۲�Ϊ3d��4s���ӣ�����ӹ��ʾ��ͼΪ![]() ���ʴ�Ϊ��N��
���ʴ�Ϊ��N��![]() ����2��a��HԪ�أ�a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ���������������е�ԭ�Ӻ���3�����ۼ���һ���µ��Ӷԣ����Ը÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������H2O2��N2H4���ʴ�Ϊ��sp3��H2O2��N2H4��
����2��a��HԪ�أ�a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ���������������е�ԭ�Ӻ���3�����ۼ���һ���µ��Ӷԣ����Ը÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������H2O2��N2H4���ʴ�Ϊ��sp3��H2O2��N2H4��
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������HNO2��HNO3������������ṹ������H2SO3���ʴ�Ϊ��HNO2��HNO3��H2SO3����4��e��c�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1��c���Ӹ���=1+8��1/8=2 ,e���Ӹ���=4�����Ըû�����ΪCu2O����e���ӵĵ��Ϊ+1���ʴ�Ϊ��+1����5����5��Ԫ���γɵ�һ��1��1�����ӻ������У������ӳ�������ṹ��˵�������ӵ�����ԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ�Ϊ��������ӣ������ӳ����������İ�����ṹ����ͼ2��ʾ��������ͼ��֪�������ӵ���λ����6���������к��й��ۼ�����λ���������Ӹ�����4��ˮ���Ӹ�����2���仯ѧʽΪ[Cu��NH3��4��H2O��2]SO4��H2O��Cu2+����λ����NH3��Cu2+���������Ըû��������ʱ����ʧȥ�������H2O����Ϊ��SO42-�����ۼ�����λ����H2O��H2O��Cu2+����λ����NH3��Cu2+����

 ��У����ϵ�д�
��У����ϵ�д�