题目内容
【题目】I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
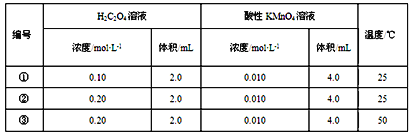
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1molH2C2O4转移___mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥___。
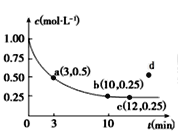
(2)探究温度对化学反应速率影响的实验编号是___(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____。
II.水煤气变换CO(g) + H2O(g)![]() CO2(g) + H2(g)是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。已知T(大于100)℃时,将2molCO(g)和3molH2O(g)通入一容积固定为2L的密闭容器中,回答下列问题:
CO2(g) + H2(g)是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。已知T(大于100)℃时,将2molCO(g)和3molH2O(g)通入一容积固定为2L的密闭容器中,回答下列问题:
(1)反应进行到1min时测得CO的物质的量为1.8mol,则H2的平均反应速率为___,此时改变某一条件,能使H2的平均反应速率加快的是___。
A.恒容时充入氖气 B.升高温度 C.将体积缩小一半 D.恒温恒容,移走CO2
(2)已知在T℃时H2(g)+CoO(s)![]() Co(s)+H2O(g) K1=1,CO(g)+CoO(s)
Co(s)+H2O(g) K1=1,CO(g)+CoO(s)![]() Co(s)+CO2(g) K2=4,求T℃时,CO(g)+H2O(g)
Co(s)+CO2(g) K2=4,求T℃时,CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为___。
CO2(g)+H2(g)的平衡常数为___。
【答案】2 5:2 ②③ ①② 0.1mol·L-1·min-1 BC 4
【解析】
I.(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥5/2=2.5;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,故答案为:②和③; ①和②;
(1) CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始(mol) 2 3 0 0
转化(mol) 0.2 0.2 0.2 0.2
1min (mol) 1.8 2.8 0.2 0.2
H2的平均反应速率为0.2 mol/(2L×1min)=0.1mol·L-1·min-1
影响化学反应速率的因素有温度、浓度、压强和催化剂,而且呈正比,所以升高温度,将体积缩小一半都可以能使H2的平均反应速率加快;故选BC。
(2)H2(g)+CoO(s)![]() Co(s)+H2O(g) K1=1①
Co(s)+H2O(g) K1=1①
CO(g)+CoO(s)![]() Co(s)+CO2(g) K2=4 ②
Co(s)+CO2(g) K2=4 ②
②-①得CO(g)+H2O(g)![]() CO2(g)+H2(g),故K=K2/K1=4。
CO2(g)+H2(g),故K=K2/K1=4。

【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
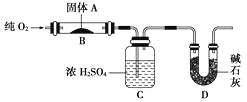
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
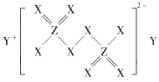
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
【题目】下列实验中,现象及得出的结论正确的是()
实验 | 现象 | 结论 | |
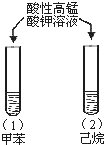
A |
| 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 甲基使苯环的活性增强 |
B |
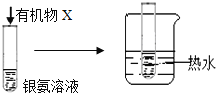
| 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
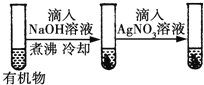
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D