题目内容
【题目】Ⅰ.白磷(P4)是磷的单质之一,易被氧化。
(1)6.20g白磷在足量氧气中完全燃烧生成P2O5,反应所消耗的氧气在标准状况下的体积为______ L。
上述燃烧产物溶于水配成50.0mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为______ mol/L。
(2)含0.300mol H3PO4的水溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2g H2O。该难溶盐的化学式可表示为______。
Ⅱ.(注:M[(NH4)2SO4]=132g/mol M(NH4Cl)=53.5g/mol M(BaSO4)=233g/mol) 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。

混合物中n[(NH4)2SO4] :n (NH4Cl)=___________。
(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=________(溶液体积变化忽略不计)。
【答案】 5.60 4.00 Ca5(PO4)3(OH) 1:2 0.l00mol·L-1
【解析】试题分析:Ⅰ.(1)6.20g白磷的物质的量是![]() ,根据化学反应
,根据化学反应![]() 计算燃烧生成P2O5所消耗的氧气在标准状况下的体积;根据磷元素守恒,生成磷酸的物质的量为
计算燃烧生成P2O5所消耗的氧气在标准状况下的体积;根据磷元素守恒,生成磷酸的物质的量为![]() ,再根据
,再根据![]() 计算磷酸的浓度;根据元素守恒书写难溶盐的化学式;Ⅱ.(1)根据图像可知生成硫酸钡的质量是2.33g,物质的量是0.01mol;根据
计算磷酸的浓度;根据元素守恒书写难溶盐的化学式;Ⅱ.(1)根据图像可知生成硫酸钡的质量是2.33g,物质的量是0.01mol;根据![]() 计算硫酸铵的物质的量。(2)根据(1)中的图像,加入100mLBa(OH)2溶液生成硫酸钡的物质的量是0.01mol,可计算Ba(OH)2溶液的浓度;根据
计算硫酸铵的物质的量。(2)根据(1)中的图像,加入100mLBa(OH)2溶液生成硫酸钡的物质的量是0.01mol,可计算Ba(OH)2溶液的浓度;根据![]() ,计算消耗氢氧化钡溶液的体积。
,计算消耗氢氧化钡溶液的体积。
解析:Ⅰ.(1)6.20g白磷的物质的量是![]() ,
,
设需要标准状况下氧气的体积是VL,
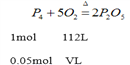
![]()
V=5.60L;
根据磷元素守恒,生成磷酸的物质的量为![]() , 该磷酸溶液的物质的量浓度
, 该磷酸溶液的物质的量浓度![]() 4.00 mol/L;
4.00 mol/L;
0.300mol H3PO4提供H+ 0.9mol、PO43- 0.3mol;0.500mol Ca(OH)2提供OH- 1mol、Ca2+ 0.5mol;生成0.9mol H2O,消耗H+ 0.9mol、OH- 0.9mol,生成盐中应该含有Ca2+ 0.5mol、PO43- 0.3mol、OH- 0.1mol,该盐的化学式是Ca5(PO4)3(OH);
Ⅱ.(1)根据图像可知生成硫酸钡的质量是2.33g,物质的量是0.01mol;
根据![]() 可知2.39g(NH4)2SO4和NH4Cl固体混合物含有(NH4)2SO4 0.01mol,(NH4)2SO4的质量0.01mol×132g/mol=1.32g;则NH4Cl的质量是2.39g-1.32g=1.07g,物质的量是
可知2.39g(NH4)2SO4和NH4Cl固体混合物含有(NH4)2SO4 0.01mol,(NH4)2SO4的质量0.01mol×132g/mol=1.32g;则NH4Cl的质量是2.39g-1.32g=1.07g,物质的量是![]() ;混合物中n[(NH4)2SO4] :n (NH4Cl)=0.01:0.02=1:2;
;混合物中n[(NH4)2SO4] :n (NH4Cl)=0.01:0.02=1:2;
(2)根据(1)中的图像,加入100mLBa(OH)2溶液生成硫酸钡的物质的量是0.01mol;消耗氢氧化钡的物质的量是0.01mol,所以Ba(OH)2溶液的浓度是![]() ;根据(1)中(NH4)2SO4和NH4Cl的物质的量可知固体混合物中含有
;根据(1)中(NH4)2SO4和NH4Cl的物质的量可知固体混合物中含有![]() =0.04mol、
=0.04mol、![]() ,根据
,根据![]() ,消耗氢氧化钡的物质的量是0.02mol,消耗氢氧化钡溶液的体积是
,消耗氢氧化钡的物质的量是0.02mol,消耗氢氧化钡溶液的体积是![]() ,
, ![]() 0.l00mol·L-1。
0.l00mol·L-1。

 阅读快车系列答案
阅读快车系列答案
