题目内容
按要求回答下列问题:
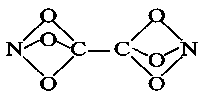
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
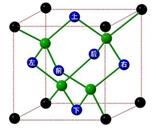
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
(1)③④(2分) ①⑤(2分) ②⑥(2分)
(2)P4、BF3(2分)
(3)SO42- (1分) CO32-(1分)
(4)6(1分) 12 (1分) CaO晶体中离子所带的电荷数大于NaCl (1分)
解析试题分析:由阴阳离子构成的晶体属于离子晶体,由分子构成的晶体属于分子晶体,由原子构成的晶体属于原子晶体,根据晶体的构成微粒判断晶体类型;属于离子晶体的是③④,属于分子晶体的是①⑤,属于原子晶体的是②⑥。对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子,对于其它的看正负电荷分布是否重合. HCN分子中分子不对称,电荷分布不均匀,为极性分子,P4分子中P-P键为非极性键,所以分子为非极性分子,SO3中硫元素化合价为+6价,硫原子最外层6个电子全部成键,为非极性分子,PCl3中P元素化合价为+3价,P原子最外层5个电子未全部成键,为极性分子,BF3中B元素化合价为+3价,B原子最外层3个电子全部成键,为非极性分子。在硫酸根离子中,S采取sp3杂化与四个氧形成共价σ键,硫酸根五个原子不在同一平面上,不会形成大π键 。在硫酸根里,S和O都是sp³杂化。硫酸根硫原子位于正四面体的中心位置上,而四个氧原子则位于它的四个顶点,故硫酸根离子VSEPR模型为正四面体形。CO32-,中心原子C价电子数是4,带2个单位负电荷,O原子达到最外层稳定结构需要2个电子.那麼:n=1/2(4-(-2)-3*2)=0,m+n=3,所以是sp2杂化.氧化钙晶体以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片可知,钙离子的配位数是6,晶格能大小于离子带电量成正比,氧化钙晶体中,钙离子,氧离子的带电量大于氯化钠晶体中,钠离子,氯离子的带电量,导致氧化钙晶格能大于氯化钠的晶格能。
考点:考查了物质结构的相关知识点。

关于化学键的下列叙述中,正确的是
| A.离子化合物不可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
下列关于化学键的叙述正确的是
| A.离子化合物中只含离子键 | B.共价化合物一定不含离子键 |
| C.离子化合物一定不含共价键 | D.共价化合物可能含有离子键 |
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
| A.CO2 | B.H3O+ | C.CH4 | D.H2SO4 |
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲:
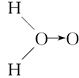 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。
(18分)水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子的空间构型为___________;水分子自身作用会生成阴、阳两种离子,其中阴离子的电子式是___________
(2)如图是某品牌饮用矿泉水标签的部分内容。请计算一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过___________。
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为b g·cm﹣3。用化学方程式表示氨气溶于水显碱性的原因___________该溶液的物质的量浓度为___________mol·L﹣1。
(4)已知M是生活中常见的一种金属,将44.8 g M完全溶于很稀的过量硝酸,向所得溶液中加入足量固体烧碱并加热,放出6.72 L(标准状况)气体。M溶于该很稀的硝酸的离子方程式为___________________。M与水在高温条件下,生成1g气体吸热a kJ,写出该反应的热化学方程式_________________________________。
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是_________________________________
②实验室中检验淀粉水解产物应选用的试剂可以是___________ (填字母)·
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |