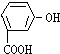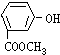题目内容
1.(1)下列物质中,属于弱电解质的是(填序号,下同)⑦⑨,属于非电解质的是④⑥⑩;①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铝 ⑩NO2
(2)甲、乙两瓶氨水的浓度分别为1mol•L-1、0.1mol•L-1,则c(OH-)甲:c(OH-)乙小于10(填“大于”、“等于”或“小于”);
(3)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为HZ>HY>HX;
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
①混合气体的颜色不再改变的状态 ②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态 ④混合气体的平均相对分子质量不再改变的状态
⑤C2(NO2)/[C2(NO)•C(O2)]的比值不再改变的状态.
分析 (1)弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质,混合物既不是电解质也不是非电解质,金属或存在自由移动的离子的溶液或熔融态物质能导电,根据定义即可解答;
(2)弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大;
(3)在相同状态下,不同弱酸电离度越大酸度越大,据此解题;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,据此分析解答.
解答 解:(1)①亚硫酸溶液是混合物,既不是电解质也不是非电解质;
②次氯酸钠属于盐,是你强电解质;
③氯化氢气体溶于水完全电离,属于强电解质;
④蔗糖在熔融状态下和水溶液里均不能导电,属于化合物,是非电解质;
⑤硫酸钡属于盐,熔融状态下完全电离,属于强电解质;
⑥氨气本身不能电离出自由移动的离子,属于化合物,是非电解质;
⑦冰醋酸溶于水后能部分电离出醋酸根离子和氢离子,属于弱电解质;
⑧硫酸氢钠固体属于盐,熔融状态和在水溶液里均能完全电离,属于强电解质;
⑨氢氧化铝属于弱碱,部分电离,是你弱电解质;
⑩NO2本身不能电离出自由移动的离子,属于非电解质,故答案为:⑦⑨,④⑥⑩;
(2)一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,
甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,
所以甲、乙两瓶氨水中[OH-]之比小于10,故答案为:小于;
(3)由电离度大小可知酸性HZ>HY>HX,故答案为:HZ>HY>HX;
(4)①混合气体的颜色不再改变时,各物质的浓度不变,说明该反应达到平衡状态,所以可以据此判断平衡状态,故正确;
②该反应的反应前后气体质量不变、容器体积不变,所以无论该反应是否达到平衡状态,反应体系的密度始终不变,所以不能据此判断平衡状态,故错误;
③该反应的反应前后是气体体积增大的可逆反应,当反应达到平衡状态时,各物质浓度不变,所以混合气体的压强不再改变,所以可以据此判断平衡状态,故正确;
④该反应的反应前后是气体体积增大的可逆反应,当反应达到平衡状态时,各物质的物质的量不变,所以其平均相对分子质量不变,则可以据此判断平衡状态,故正确;
⑤该反应的反应前后有热量变化,当该反应达到平衡状态时,反应体系温度不再发生变化,所以$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$不再变化,则可以据此判断平衡状态,故正确.
故选①③④⑤.
点评 本题考查了电解质与非电解质的概念、溶液中离子浓度大小判断、酸性强弱比较以及化学平衡状态的判断,平衡的判定:只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | 碘 | B. | 锌 | C. | 铁 | D. | 铜 |
 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 该物质既有氧化性又有还原性 | |
| B. | 分子中四个氮原子共平面 | |
| C. | 分子中N、O间形成的共价键是非极性键 | |
| D. | 15.2g该物质含有6.02×1022个原子 |
| A. | O2 | B. | Na2O | C. | NaCl | D. | SO2 |
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ②③①④ |

| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OCH2CH2CH3 | ||
| C. | (CH3)2CH2OCH2(CH3)2 | D. | CH3CH2OCH2CH3 |