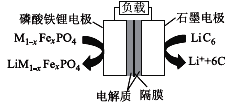
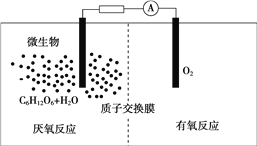
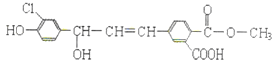题目内容
【题目】铁的氧化物成分不一样,性质也不一样, H2还原Fe2O3,发现温度不同,产物也不同。
(1)往产物中滴加盐酸,观察到有气泡产生,生成气泡主要成分的电子式是________。
(2)再滴加KSCN溶液,可观察到________,所得溶液中一定含有的铁的化合价是________。
【答案】H∶H 无明显变化 +2
【解析】
(1)产物中滴加盐酸,观察到有气泡产生,说明产生中含有Fe,所以气体成分为H2;
(2)再滴加KSCN溶液,没有出现血红色现象,产物中有过量的铁,铁能还原Fe3+,所得溶液中一定含有Fe2+。
(1)产物中滴加盐酸,铁的氧化物首先与盐酸反应,生成相应的铁的氯化物和水,若生成Fe3+,则会被Fe还原为Fe2+。观察到有气泡产生,说明最后发生的是Fe与盐酸的反应,所以气体成分为H2,电子式为![]() ;答案为
;答案为![]() ;
;
(2)再滴加KSCN溶液,因为不含有Fe3+,所以没有明显现象产生;产物中有过量的铁,铁能还原Fe3+,所得溶液中一定含有Fe2+,铁的化合价是+2。答案为:无明显现象;+2。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】右图为浓硫酸与铜片反应的装置。
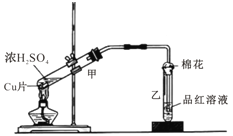
请回答:
(1)浓硫酸与铜片反应的化学方程式为 。
(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性 |
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染 |
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色 |
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况) |
【题目】电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
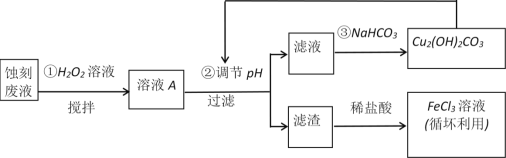
请回答:
(1)把FeCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________。
(4)已知:生成氢氧化物沉淀的pH如下表
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是________________。
(5)上述流程路线中,除FeCl3溶液外,还可用于循坏利用的物质是__________________。