题目内容
5.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol•L-1,SO42-的物质的量浓度为0.7mol•L-1,则此溶液中K+的物质的量浓度(mol•L-1)为( )| A. | 0.1 | B. | 0.15 | C. | 0.2 | D. | 0.25 |
分析 根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此结合题中数据进行解答.
解答 解:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
则:3×0.4mol/L+c(K+)=2×0.7mol/L,
所以溶液中钾离子浓度为:c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.
点评 本题考查混合溶液中离子物质的量浓度的计算,题目难度中等,注意溶液中离子浓度计算中电荷守恒的运用,明确物质的量浓度的概念及计算方法.

练习册系列答案
相关题目
13.把3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应:3A(气)+B(气)?xC(气)+2D(气)经过5min后达到平衡生成1mol D,测得C的平均生成速率为0.10mol•L-1•min-1.下列叙述正确的是( )
| A. | A的平均消耗速率为0.32mol•L-1•min-1 | |
| B. | B的转化率为80% | |
| C. | x的值为2 | |
| D. | B的平衡浓度为1mol•L-1 |
20.能用能量判断下列过程的方向的是( )
| A. | 水总是自发地由高处往低处流 | |
| B. | 有序排列的火柴散落时成为无序排列 | |
| C. | 放热反应容易进行,吸热反应不能自发进行 | |
| D. | 多次洗牌以后,扑克牌的毫无规律的混乱排列的几大 |
15.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | K+、Na+、H+、C1- | B. | Na+、Ba2+、Mg2+、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | K+、Na+、CO32-、S2- |
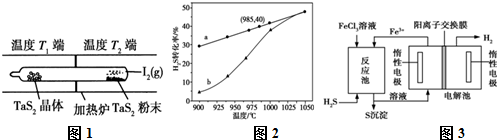

 CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图:
CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用铜粉氧化法生产CuO的流程图: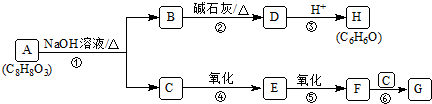
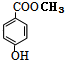 .
. .
.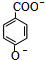 +CH3OH+H2O.
+CH3OH+H2O. ,该反应类型是缩聚.
,该反应类型是缩聚. .
.