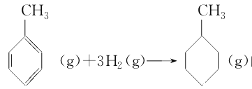��Ŀ����
����Ŀ���������������������ȡ��κ͵��ʣ���һ����;�㷺�Ļ���ԭ�ϡ�
��1����ͼ�ǵ���Ӧ���а���n��N2��:n��H2��=1:3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�

������a��Ӧ���¶��� ��
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ���� ������ĸ����
A����ʱ�����NH3�������H2��ƽ��ת����
B���Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K��M��= K��Q�� >K��N��
�� M���Ӧ��H2ת������ ��
��2����ҵ�������β���к��϶��SO2��Ϊ��ֹ��Ⱦ��������������SO2����ҵ�ϳ��ð�ˮ���շ�����β��������ˮ�������������ʵ���Ϊ3 mol �����ձ�״����44.8 L SO2ʱ����Һ�е�����Ϊ ��
��3��������һ�ָ���ȼ�ϣ�����ֱ������ȼ�ϵ�أ���ͼ�ǹ���ˮʽȼ�ϵ�ع���ԭ����

�ٰ���ȼ�ϵ�صĵ������Һ���ѡ�� ������ԡ��������ԡ������ԡ�����Һ��
�ڿ����ڽ�����װ��ǰ��Ҫͨ����������ȥ�������� ��
�۰���ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ������������ˮ���õ�������ĵ缫��Ӧ����ʽ�� ��
���𰸡���200�棨1�֣���AC��2�֣� ��75%��2�֣�
��2����NH4��2SO3��NH4HSO3��2�֣���3���ټ��ԣ�1�֣���CO2��1�֣�
��3O2+12e-+6H2O��12OH-��O2+4e-+2H2O��4OH-��2����
��������
�����������1�����ϳɰ���Ӧ���ȣ������¶ȣ�ƽ�������ƶ������İٷֺ������ߣ����¶�Խ�Ͱ����İٷֺ���Խ�ߣ����ԣ�����a��Ӧ���¶���200����
��A����С������Ũ��ƽ�������ƶ�����ʱ�����NH3�������H2��ƽ��ת���ʣ�A��ȷ��B��������Ӱ��ƽ���ƶ����Ӵ����ܼӿ췴Ӧ���ʵ��������H2��ƽ��ת���ʣ�B����C��Kֻ���¶�Ӱ�죬�÷�Ӧ�¶�����ʱKֵ��С��b��400����c��600������ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K��M��=K��Q����K��N����C��ȷ��ѡAC��
�� 3N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��ʼ����mol�� 1 3 0
ת������mol�� x 3x 2x
ƽ������mol�� 1-x 3-3x 2x
������M��ʱ��2x/��4-2x��=60%����x=3/4����������ת����Ϊ75%��
��2���������ʵ���Ϊ3mol�����ձ�״����44.8L SO2ʱ��Nԭ��3mol��Sԭ��2mol����ԭ���غ㣬�ڣ�NH4��2SO3�У���ԭ�Ӹ�����N��S=2��1�����У�NH4HSO3����ԭ�Ӹ�����N��S=1��1�����ԣ��������У�NH4��2SO3��NH4HSO3��
��3���������Ǽ������壬���Ե��Һ���ѡ����Ե���
�������е�CO2�ܺͰ�ˮ��Ӧ��������ȥ��������CO2��
����������������Ӧ��������������Ӧ��ע��ʱ���Ի��������ԣ������ĵ缫��ӦʽΪ��O2+4e-+2H2O=4OH-��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�