题目内容
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )
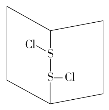
A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
【答案】A
【解析】
A、根据S2Cl2的结构,S2Cl2不是对称结构,S2Cl2为极性分子,故A说法错误;
B、S和Cl之间形成共价键为极性键,S和S之间形成共价键为非极性键,故B说法正确;
C、S2Cl2与S2Br2结构相似,通过分子间作用力或范德华力进行分析,S2Br2相对分子质量大于S2Cl2的相对分子质量,S2Br2分子间的范德华力大于S2Cl2分子间的范德华力,即S2Br2的熔沸点高于S2Cl2,故C说法正确;
D、S2Cl2与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,故D说法正确。

 期末1卷素质教育评估卷系列答案
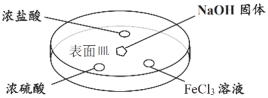
期末1卷素质教育评估卷系列答案【题目】某兴趣小组研究含铁元素的盐类物质的制备、保存和性质。
实验I. 配制FeCl2溶液:向0.1 mol·L-1 FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是__________。
(2)在老师的指导下,配制的FeCl2溶液底部仍保留一层铁粉,请说明该操作的必要性__________。
实验II. 通过Fe(NO3)2的性质实验,探究试剂添加顺序的不同对现象和反应的影响。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 mol/L Fe(NO3)2溶液 | 实验i: 先滴加1.0 mL 0.5 mol·L-1 NaOH溶液; 再滴加1.5mL 1.0 mol·L-1 H2SO4溶液 | i. 滴加NaOH溶液后__________;加酸后溶液变为黄色 |
实验ii: 先滴加1.5 mL 1.0 mol·L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L-1 NaOH溶液 | ii. 加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | ||
(3)实验i中滴加NaOH溶液后出现的一系列现象是__________;请用化学或离子方程式说明Fe(NO3)2溶液中滴加碱溶液后出现此系列现象的原因__________、__________。
(4)探究实验ii中先滴加H2SO4溶液时Fe(NO3)2溶液中是否发生了反应:
A. 向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中__________(填写具体实验方法),溶液立即变红,说明加酸时溶液中发生了反应,生成了Fe3+。
B. 推测溶液中产生Fe3+的可能原因有两种:
a. 酸性条件下,__________;
b. 酸性条件下,Fe2+可能被空气中的O2氧化,写出相应的离子方程式:___________。