题目内容
食盐是日常生活的必需品,也是重要的化工原料.
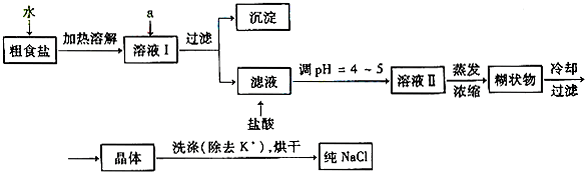
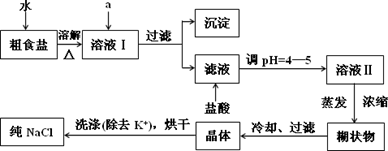
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2溶液,75%乙醇,四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1的NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
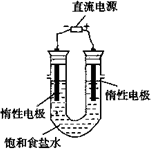
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________.
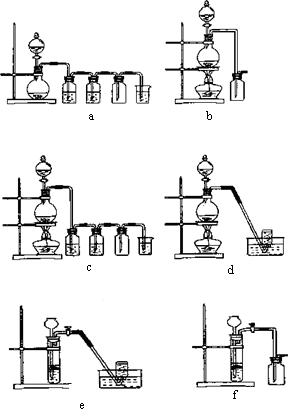
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).可选用制备气体的装置:
解析:
|
(1)①BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3;或BaCl2、Na2CO3、NaOH)(2分) ②75%乙醇(2分) (2)天平、烧杯、500 mL容量瓶、胶头滴管(4分) (3)<(2分) 电解生成的氯气一部分溶于水(2分) 酸碱中和滴定(2分) (4)e(1分) c(1分) |