题目内容
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
 H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是| A.加入NaOH | B.加入盐酸 |
| C.加水 | D.升高温度 |
D
A错误,加碱使醋酸电离平衡正向移动,但消耗了氢离子,使氢离子浓度减少。
B错误,加盐酸使溶液氢离子增加,但醋酸电离平衡逆向移动。
C错误,加水稀释,醋酸电离平衡正向移动,但氢离子浓度减少。
D正确,升高温度,醋酸电离正向移动,氢离子浓度增加。
B错误,加盐酸使溶液氢离子增加,但醋酸电离平衡逆向移动。
C错误,加水稀释,醋酸电离平衡正向移动,但氢离子浓度减少。
D正确,升高温度,醋酸电离正向移动,氢离子浓度增加。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
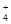 、Al3+、SO
、Al3+、SO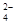 、NO
、NO
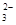 、NO
、NO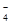 、SO
、SO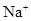 、
、 、
、 、
、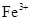
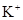 、CO32-、
、CO32-、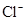 、
、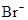
 、
、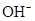 、
、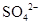
 ) = 1×10
) = 1×10