题目内容
8.1989年世界卫生组织把铝确定为食品污染源之一,对在食品中的应用加以限制.按照这一要求,铝在下列应用中应加以控制的是( )①铝合金
②制电线
③制炊具
④银色漆颜料
⑤用明矾净化饮用水
⑥明矾与小苏打制食品膨松剂
⑦饮料易拉罐
⑧用氢氧化铝凝胶制胃舒平药品
⑨包装糖果和小食品.
| A. | ①③⑤⑧⑨ | B. | ②④⑤⑧⑨ | C. | ①②③⑤⑦ | D. | ③⑤⑥⑦⑧⑨ |
分析 铝制炊具在烹制食物时铝可能随食物进入人体,明矾是十二水硫酸铝钾,其中含有铝,在净化水的过程中铝可能随水进入人体,也可能随食品进入人体,铝制易拉罐中的铝可能随饮料进入人体,胃舒平药剂中的铝对人体有危害,包装糖果和小食品的铝也可能进入人体.
解答 解:使用铝制品包装食品、制炊具可能对人体有危害,用含有铝的物质净化水或制药物或制食品蓬松剂对人体有危害,分析上述应用可知,③⑤⑥⑦⑧⑨应加以控制,
故选D.
点评 本题考查了铝的性质和应用,解答本题要掌握铝可能进入人体的途径,例如铝可以通过饮食、药物等途径进入人体从而危害人体健康,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列过程中属于△H小于零的反应的是( )
| A. | 氯酸钾分解 | B. | 氢气还原氧化铜 | ||
| C. | 浓硫酸的稀释 | D. | 铝片与浓盐酸的反应 |
16.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 含有相同铜原子数的Cu2S和CuO的质量相等 | |
| B. | 2g氢气所含质子数目为NA | |
| C. | lmol氨气含有的原子数目为2NA | |
| D. | 22.4LCH4所含电子数目为l0NA |
13.下列对于有机物的结构简式、键线式书写错误的是( )
| A. | 丙炔:CH≡C-CH3 | |
| B. | 丙烯:CH2CHCH3 | |
| C. | 2丁烯的结构简式为CH3CH═CHCH3,其键线式为 | |
| D. | 乙醇:CH3CH2OH |
17.FeSO4•7H2O广泛用于医药和工业领域,实验室制备FeSO4•7H2O的流程如下:
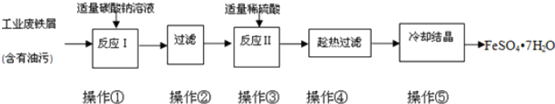
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
该补血剂中铁元素的质量分数为16.8%.

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
18.已知混合烃的平均分子式为C1.5H4,则还混合烃中( )
| A. | 一定没有甲烷 | B. | 一定有乙烯 | C. | 一定有丙烷 | D. | 一定没有乙烷 |
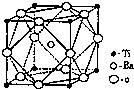 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: