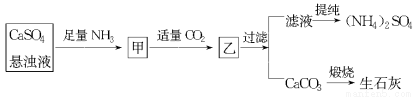
题目内容
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
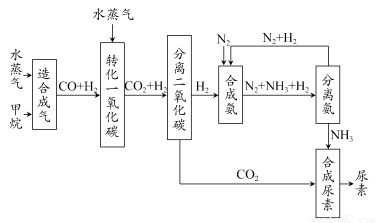
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是___________。
(2)上述流程中,工业上分离H2、CO2合理的方法是_____________________。
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行________,目的是________________;
在合成氨的实际生产过程中,常采取将生成的氨从混合气体中分离出来,分离出氨的方法:________________。
(4)合理地利用资源不仅可以提高经济效益,而且也是对社会、对全人类负责的表现,请用线段和箭头画出图中的两处合理利用资源情况。
(1)CH4(g)+H2O(g)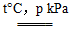 CO(g)+3H2(g) ΔH=+2a kJ·mol-1
CO(g)+3H2(g) ΔH=+2a kJ·mol-1
(2)BC
(3)净化 防止空气中某些杂质使催化剂中毒 液化氨(或分离液态氨)
(4)由分离氨的框用箭头指向合成氨框,分离二氧化碳框指向合成尿素框。
【解析】(1)由于1 mol CH4与1 mol H2O反应时吸收的热量为2a kJ,由此书写热化学方程式。
(2)分离的原则是不引入新杂质,A中加入盐酸后产生的CO2中又混有HCl杂质,而C中产生的铵盐受热分解产生CO2同时又产生NH3,二者可合成尿素,NH3并非杂质气体。D项消耗大量能源,不经济。
(3)由于合成氨工业中的催化剂易中毒,所以合成气须净化,以免引起催化剂中毒,根据氨易液化的特点,常用分离液态氨法来实现原料的循环利用。
(4)合理利用资源,就是将产生的没有参加反应的物质又补充到反应中去。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案