题目内容
已知实验室制氯气的化学方程式为:MnO2 + 4HCl (浓) = MnCl2 + Cl2+2H2O,现用足量浓盐酸在加热条件下跟1.74g二氧化锰反应制取氯气。求:
(1)产生的氯气在标准状况下的体积。
(2)把(1)中反应后的溶液稀释到100 mL,从中取出20.0 mL,加入40.0 mL 0.600 mol / L的硝酸银溶液,恰好将氯离子完全沉淀。求(1)中反应后溶液稀释到100 mL时氯离子的物质的量浓度是多少?
【答案】
(1)0.448 L (2)1.20 mol/L
【解析】
试题分析:(1)二氧化锰的物质的量是1.74g÷87g/mol=0.02mol
反应的方程式是
MnO2 + 4HCl (浓) MnCl2 + Cl2+2H2O
MnCl2 + Cl2+2H2O
1mol 1mol 22.4L
0.02mol 0.02mol 0.448L
即生成的氯气是0.448L
(2)硝酸银的物质的量是0.04L× 0.600 mol / L=0.24mol
反应的离子方程式是
Ag+ + Cl-=AgCl↓
1mol 1mol
0.24mol 0.24mol
则反应后溶液稀释到100 mL时氯离子的物质的量浓度是0.24mol÷0.02L=1.20mol/L
考点:考查二氧化锰和浓盐酸反应的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。试题贴近高考,基础性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。有利于提高学生的应试能力和规范答题能力。该题的关键是明确反应的原理以及物质的量浓度的计算依据,然后结合题意灵活运用即可。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。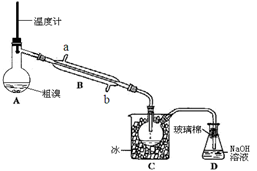
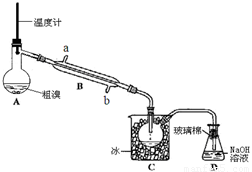
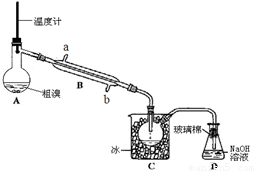
 ①反应过程中需要对A容器加热,加热的方法是
。
①反应过程中需要对A容器加热,加热的方法是
。