题目内容
(11分) 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
(1)(10-5-10-9)mol/L(1分); bcf(3分)
(2)< (1分) =(1分)
(3) Va< Vb(1分)
(4) c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-)(2分)
(5)2.05×10-11(2分)
【解析】
试题分析:(1)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,根据水的电离平衡及醋酸的电离平衡方程式CH3COOH⇌H++CH3COO-可以看出,c(CH3COO-)=c(H+)溶液中- c(H+)水电离=(10-5-10-9)mol/L;加热、加水稀释、加入碱性物质均能使电离平衡向右移动,故选bcf;
(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以醋酸产生的氢气体积较大,开始时,醋酸和盐酸的pH均等于3,即开始时氢离子的浓度相等,所以开始时的速率相等;
(3)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,说明碱多,所以Va< Vb;
(4)根据电荷守恒:c(CH3COO-)+c(Cl-)+c(OH-)= c(Na+)+ c(H+),溶液为中性,可以知道c(CH3COO-)+c(Cl-) = c(Na+),所以c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);
(5)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氢氧化钠溶液中:
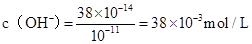 ,混合后碱剩余,剩余的氢氧根的浓度为:
,混合后碱剩余,剩余的氢氧根的浓度为:
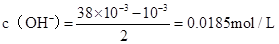 ,
,
所以 。
。
考点:弱电解质在水溶液中的电离平衡及pH计算。
点评:本题考查学生有关弱电解质的电离和离子浓度大小比较的知识,是一道综合知识题目,难度较大。

 a
a 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。