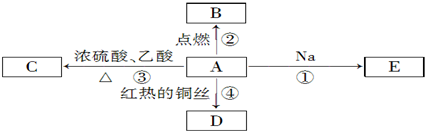
题目内容
11.有下列几种晶体:A.SiC B.CO2 C.水晶 D.白磷 E.晶体氩 F.氯化铵 G.金刚石 H.铁
(1)其中经常用作玻璃刀刀头的是G
(2)属于原子晶体的化合物是AC
(3)含有共价键的离子晶体是F
(4)受热熔化后化学键不发生变化的是DE
(5)其水溶液下能导电的是BF.
分析 (1)经常用作玻璃刀刀头的晶体硬度必须大,应该选取原子晶体;
(2)由原子构成的晶体是原子晶体;
(3)有阴阳离子构成的晶体是离子晶体,非金属元素之间易形成共价键;
(4)受热熔化后化学键不发生变化的晶体是分子晶体,在固态、液态或气态时都以分子存在;
(5)溶于水后会导致溶液中含有大量自由移动离子的物质其水溶液能导电.
解答 解:(1)金刚石硬度较大,经常用作玻璃刀刀头,故选G;
(2)由原子构成的晶体是原子晶体,这几种物质中由原子构成的是石英、SiC、金刚石,但金刚石是单质,故选AC;
(3)有阴阳离子构成的晶体是离子晶体,非金属元素之间易形成共价键,含有共价键的离子晶体是氯化铵,故选F;
(4)分子晶体受热熔化后化学键不发生变化,二氧化碳、白磷、晶体氩都属于分子晶体,但二氧化碳气体,所以受热熔化都不破坏化学键,故选DE;
(5)溶于水后会导致溶液中含有大量自由移动离子的物质其水溶液能导电,二氧化碳和水反应生成碳酸,碳酸电离出自由移动离子而导致其水溶液导电,氯化铵溶于水电离出自由移动阴阳离子而使其水溶液导电,故选BF.
点评 本题考查晶体类型判断、化学键等知识点,根据物质的构成微粒及化学键判断晶体类型,注意氯化铵虽然是离子晶体,但受热易分解生成共价化合物.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
1. 水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
(1)纯水在25℃时,pH=7,该温度下1mol•L-1的NaOH溶液中,由水电离出的
c(OH-)=10-14mol•L-1.
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为C${O}_{3}^{2-}$+H2O?HC${O}_{3}^{-}$+OH-、HC${O}_{3}^{-}$+H2OH2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
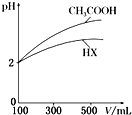
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离常数小于(填“大于”“小于”或“等于”)CH3COOH的电离常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离常数较小.
(4)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
 水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:
水是生命的源泉、工业的血液、城市的命脉.请回答下列问题:(1)纯水在25℃时,pH=7,该温度下1mol•L-1的NaOH溶液中,由水电离出的
c(OH-)=10-14mol•L-1.
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为C${O}_{3}^{2-}$+H2O?HC${O}_{3}^{-}$+OH-、HC${O}_{3}^{-}$+H2OH2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离常数小于(填“大于”“小于”或“等于”)CH3COOH的电离常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离常数较小.
(4)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
2.下列说法正确的是( )
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 通过化学反应从海水中可提取氯化钠、溴、碘等物质 | |
| C. | 为了增强高锰酸钾溶液的氧化性可用盐酸酸化 | |
| D. | ClO2是一种有刺激性气味的黄绿色气体,除用于杀菌消毒外,还广泛用于环保、漂白、除臭 等方面 |
19.钛(Ti)金属常被称为未来钢铁.钛元素的同位素${\;}_{22}^{46}$Ti、${\;}_{22}^{47}$Ti、${\;}_{22}^{48}$Ti、${\;}_{22}^{49}$Ti、${\;}_{22}^{50}$Ti中,中子数不可能为( )
| A. | 26 | B. | 28 | C. | 22 | D. | 24 |
6.以下关于混合物分离提纯操作或原理说法不正确的是( )
| A. | 实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法 | |
| B. | 用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液 | |
| C. | 利用植物油的密度比水小且不溶于水的原理,可用分液的方法分离这两种液体混合物 | |
| D. | 蒸馏时,温度计的水银球应充分接触溶液 |
16.下列有关海水综合利用的说法正确的是( )
| A. | 工业上通过氧化法提取海水中的溴 | |
| B. | 工业上电解氯化钠溶液制取单质钠 | |
| C. | 工业利用冷却结晶法提取海水中的食盐 | |
| D. | 利用过滤法除去海水中的杂质生产淡水 |
3.下列离子方程式正确的是( )
| A. | 碳酸钙和盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+ | |
| B. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| C. | 溴水滴入碘化钾溶液:Br2+I-═Br-+I2 | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 水电离的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、AlO2-、Cl- | |
| B. | 使石蕊变红色的溶液中:Na+、Al3+、SO42-、CO32- | |
| C. | Kw/C(H+)=1×10-13mol•L-1的溶液中:NH4+、Fe3+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、SO42- |