题目内容
11.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Cs>Na.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①非金属性越强,气态氢化物越稳定;
②电子层数越多,半径越大,同一周期,原子序数越大,半径越小;
③非金属性越强,最高价氧化物的水化物的酸性越强;
④元素的金属性越强,其原子失电子能力越强.
解答 解:①非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故①错误;
②电子层数越多,半径越大,同一周期,原子序数越大,半径越小,故原子半径Na>Mh>O正确,故②正确;
③非金属性Cl>S>P,最高价氧化物的水化物的酸性为HClO4>H2SO4>H3PO4,故③错误;
④金属性Cs>K>Na>Li,则失电子能力:Cs>Na,故④正确,故选B.
点评 本题考查元素性质的比较,为高频考点,把握元素的金属性、非金属性比较为解答的关键,注意元素的位置及元素周期律的应用,D为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.如表是不同温度下水的离子积数据:
试回答以下几个问题:
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”);
(2)在25℃下,0.05mol/L的Ba(OH)2溶液的pH=13;
(3)在25℃下,pH=10的NaOH溶液中,水电离产生的c(OH-)为:1×10-10mol/L;
(4)在t2℃下,将pH=9的氢氧化钠溶液V1L与pH=4的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=7,则V1:V2=$\frac{1}{9}$.
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2•L-2 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”);
(2)在25℃下,0.05mol/L的Ba(OH)2溶液的pH=13;
(3)在25℃下,pH=10的NaOH溶液中,水电离产生的c(OH-)为:1×10-10mol/L;
(4)在t2℃下,将pH=9的氢氧化钠溶液V1L与pH=4的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=7,则V1:V2=$\frac{1}{9}$.
2.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F原子结构示意图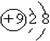 | ||
| C. | 用电子式表示HCl形成过程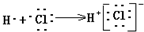 | D. | 羟基:-OH |
19.下列关于葡萄糖(C6H12O6)和维生素C(C6H8O6)的说法中正确的是( )
| A. | 葡萄糖和维生素C中含有的碳、氧原子个数相等 | |
| B. | 葡萄糖和维生素C中碳元素和氧元素的质量比都是l:1 | |
| C. | -个葡萄糖分子比-个维生素C分子多4个氢原子 | |
| D. | -个维生素C分子中的中子数和电子数一定相等 |
6.对于密闭容器中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达化学平衡后,改变条件,下列表达不正确的是( )
| A. | 增大压强,化学平衡不一定发生移动 | |
| B. | 通入氦气,化学平衡不一定发生移动 | |
| C. | 增加Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
16.铷和另一种碱金属的合金46g,与水完全反应,放出2g的氢气,则合金中另一种金属是( )
| A. | Li | B. | Na | C. | K | D. | Cs |
3.下列说法正确的是( )
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 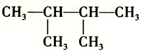 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 | |
| D. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 |
20.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: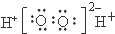 | B. | CS2的比例模型: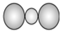 | ||
| C. | 14C的原子结构示意图: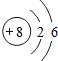 | D. | CCl4的结构式: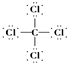 |
1.有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
| A. | 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强 | |
| B. | 常温时水溶性:Na2CO3>NaHCO3 | |
| C. | 在酒精灯加热的条件下,前者不分解,后者分解 | |
| D. | 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀 |