题目内容
【题目】[化学—选修3:物质结构与性质]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是 ;
31Ga的第一电离能却明显低于30Zn,原因是 ;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3 分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是: (用相关的离子方程式和简单的文字说明加以解释)
(3)图甲所示的二维平面晶体示意图中表示化学式为AX3的是________。
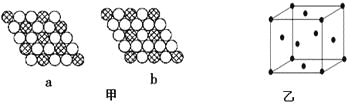
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
【答案】Ⅰ.31Ga的电子排布式是:1s22s22p63s23p63d104s24p1(2分)
30Zn的4s能级处于全充满状态,较稳定(2分)
Ⅱ.(1)![]() (只写三键没标明配位键给2分)(2分) sp3(1分)三角锥型(1分)
(只写三键没标明配位键给2分)(2分) sp3(1分)三角锥型(1分)
(2)蓝色沉淀与氨水可发生如下反应:
Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++4H2O+2OH-,生成的[Cu(NH3)4]SO4在极性较小的乙醇中溶解度较小而析出 (3分)
(3)b (2分)
(4)![]() mol-1(2分)
mol-1(2分)
【解析】试题分析:I、根据核外电子的排布规律,31号元素的核外电子排布式为1s22s22p63s23p63d104s24p1;30Zn的最外层电子排布是4s2,属于全充满状态,比较稳定,所以30Zn的第一电离能较大;
II、(1)CO与N2互为等电子体,氮气 的结构中有三键,所以CO分子中也有三键结构,CO分子中C原子上有一孤电子对,说明C原子提供2个电子,O原子提供4个电子,其中有1对电子与C原子的2p轨道形成配位键,所以CO的结构式是![]() ;氨气分子中的N原子的价层电子对数是4,有1对孤对电子,所以氨气的空间构型是三角锥型,为sp3杂化;
;氨气分子中的N原子的价层电子对数是4,有1对孤对电子,所以氨气的空间构型是三角锥型,为sp3杂化;
(2)蓝色沉淀是氢氧化铜沉淀,氢氧化铜与氨水反应生成四氨合铜离子,Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++4H2O+2OH-,生成的深蓝色[Cu(NH3)4]SO4在极性较小的乙醇中溶解度较小而析出;
(3)a图中6个X原子构成一个正六边形,每个X原子被3个正六边形共有,正六边形的中心有1个A原子,所以每个正六边形中的X的原子的个数实际是6×1/3=2,则a图表示的化学式是AX2;b图中6个X原子构成一个正六边形,每个X原子被2个正六边形共有,正六边形的中心有1个A原子,所以每个正六边形中的X的原子的个数实际是6×1/2=3,则b图表示的化学式是AX3,答案选b;
(4)铜的晶胞中Cu原子分别位于面心和顶点,所以晶胞中Cu的个数实际是6×1/2+8×1/8=4,所以晶胞密度ρg/cm3=64g/mol/NA×4/a3cm3,则NA=![]() mol-1
mol-1

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是 ( )
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
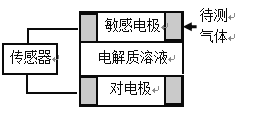
A. 上述气体检测时,敏感电极均作电池正极
B. 检测H2S气体时,对电极充入空气,该电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
C. 检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
D. 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同


