题目内容
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
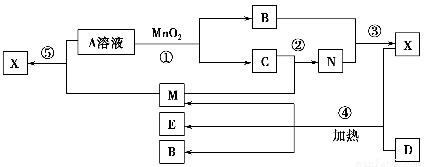
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
(1)①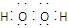 Fe ②2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
Fe ②2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(2)448 1
(3)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(4)C
【解析】本题以框图推断为载体,主要考查了硫、铁及其化合物的性质,意在考查考生的推断能力及实验能力。(1)A、B均为液体,且组成相同,可能是H2O和H2O2,H2O2在MnO2催化下可分解生成水和O2,故A为H2O2,B为H2O,C为O2;固体单质D与X的浓溶液在常温下不反应,加热时反应生成M、E和H2O,M能与O2反应,D与E溶液能够发生化合反应,且反应前后溶液颜色有变化,则D为Fe,M为SO2,E为Fe2(SO4)3,N为SO3,X为H2SO4。①H2O2中O为-1价,氧原子之间共用一对电子,电子式为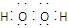 。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。
。②SO2具有还原性,Fe3+具有较强的氧化性,SO2在水溶液中可被Fe3+氧化成硫酸。(2)若D为红色单质,则D为Cu,Cu与浓硫酸反应得到的E为CuSO4,用惰性电极电解硫酸铜溶液过程中,阳极生成O2,导线中通过0.08 mol电子时,阳极共生成0.02 mol O2,其体积在标准状况下为448 mL。原溶液中n(CuSO4)=0.1 L×0.05 mol·L-1=0.005 mol,若Cu2+完全反应,转移电子0.005 mol×2=0.01 mol,而实际转移电子为0.08 mol,则说明还存在水的电解,故硫酸铜经电解后完全转化为H2SO4,则c(H+)=2c(CuSO4)=2×0.05 mol·L-1=0.1 mol·L-1,故pH=1。(3)短周期元素中能形成黑色固体单质的是碳,碳与浓硫酸在加热条件下可反应生成CO2、SO2和水。(4)SO2、CO2均是酸性氧化物,与碱反应的现象相似;但SO2具有漂白性和还原性,故可用品红溶液检验SO2,然后用酸性高锰酸钾溶液除去SO2,再用品红溶液检验SO2是否除尽,最后用澄清石灰水检验CO2。由于检验SO2和CO2的试剂均是水溶液,故需首先用无水CuSO4检验产物中的水蒸气,合理的选项为C。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案