题目内容
下列选项中所涉及的两个量一定相等的是( )
| A、电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| B、6.29 Na2O 和7.89 Na2O2中所含的离子数 |
| C、11.2L N2与14g CO气体所含有的原子数 |
| D、20g重水(D2O)与34g NH3所含有的电子数 |
考点:物质分子中的原子个数计算,电解原理
专题:计算题
分析:A.电解精炼粗铜时,阳极溶解的铜小于阴极析出的铜;
B.氧化钠和过氧化钠化学式中阴阳离子个数相等;
C.温度和压强未知,无法计算氮气的物质的量;
D.一个重水分子中含有10个电子,20g重水的物质的量=
=1mol,含有的电子数10NA,一个NH3分子数为10个电子,34g NH3的物质的量为2mol,含有的电子数20NA.
B.氧化钠和过氧化钠化学式中阴阳离子个数相等;
C.温度和压强未知,无法计算氮气的物质的量;
D.一个重水分子中含有10个电子,20g重水的物质的量=
| 20g |
| 20g/mol |
解答:
解:A、电解精炼粗铜时,阳极上铜和其它金属溶解,阴极上析出铜,根据转移电子相等知,阳极溶解的铜小于阴极析出的铜,故A错误;
B、氧化钠和过氧化钠化学式中阴阳离子个数相等,Na2O的物质的量=
=0.1mol,7.8 g Na2O2的物质的量=
=0.1mol,所以6.2 g Na2O和7.8 g Na2O2中所含的离子数相等,故B正确;
C、温度和压强未知,无法计算氮气的物质的量,14gCO的物质的量=
=0.5mol,所以其含有的原子个数不一定相等,故C错误;
D、一个重水分子中含有10个电子,20g重水的物质的量=
=1mol,含有的电子数10NA,一个NH3分子数为10个电子,34g NH3的物质的量为2mol,含有的电子数20NA,故D错误;
故选B.
B、氧化钠和过氧化钠化学式中阴阳离子个数相等,Na2O的物质的量=
| 6.2g |
| 62g/mol |
| 7.8g |
| 78g/mol |
C、温度和压强未知,无法计算氮气的物质的量,14gCO的物质的量=
| 14g |
| 28g/mol |
D、一个重水分子中含有10个电子,20g重水的物质的量=
| 20g |
| 20g/mol |
故选B.
点评:本题考查了物质的量的计算、电解原理等知识点,根据物质构成、电解原理、基本公式等知识点来分析解答,注意气体摩尔体积的适用范围及适用条件,知道过氧化钠、氧化钠的构成微粒,题目难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
同物质的量浓度的KCl、CaCl2、AlCl3三种溶液的体积比为3:2:1,这三种溶液中Cl-浓度之比是( )
| A、3:2:1 |
| B、1:2:3 |
| C、1:1:1 |
| D、2:3:1 |
下列反应中,不属于四种基本反应类型是( )
| A、2Na+2H2O═2NaOH+H2↑ | ||||
| B、2HClO═2HCl+O2↑ | ||||
| C、Fe+2FeCl3═3FeCl2 | ||||
D、CuO+CO
|
下列关于有机物的性质或应用说法不正确的是( )
| A、用饱和的CuSO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质 |
| B、淀粉和纤维素的组成都可用(C6H10O5)n表示,它们都可转化为葡萄糖 |
| C、煤通过干馏可得到焦炭、煤焦油、焦炉气、粗氨水等 |
| D、油脂皂化反应的产物是高级脂肪酸钠和甘油 |
下列关于淀粉和纤维素的叙述中,不正确的是( )
| A、都属于糖类,且都是多糖 |
| B、水解的最终产物都是葡萄糖 |
| C、通式都是(C6H10O5)n,互为同分异构体 |
| D、它们都是天然高分子化合物 |
某有机物的结构简式是: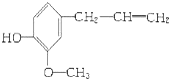 该物质不应有的化学性质是( )
该物质不应有的化学性质是( )
①可以燃烧
②可以跟溴加成
③可以将KMnO4酸性溶液还原
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以发生消去反应.
 该物质不应有的化学性质是( )
该物质不应有的化学性质是( )①可以燃烧
②可以跟溴加成
③可以将KMnO4酸性溶液还原
④可以跟NaHCO3溶液反应
⑤可以跟NaOH溶液反应
⑥可以发生消去反应.
| A、①③ | B、③⑥ | C、④⑥ | D、④⑤ |
下列有关说法中错误的是( )
| A、随着原子序数的增大,同周期简单离子的半径依次减小 |
| B、元素周期表中原子半径最小和最大的元素在同一主族 |
| C、王水是浓硝酸和浓盐酸以体积比1:3混合的溶液 |
| D、1L 1mol?L的氨水中NH3、NH4+、NH3?H2O的物质的量之和为1mol |
下列离子方程式书写不正确的是( )
| A、常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
| B、AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| D、FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ |
下列离子方程式书写正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |