题目内容
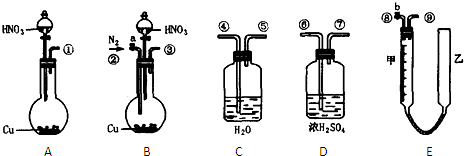
为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从如图所示选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值.其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),供量气用,乙管可上下移动,用来调节液面高低.
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择______(填装置序号).
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验.因此,中和滴定前必须进行的操作是______.
(3)装置的连接顺序是(填各装置接口的编号,连结胶管及夹持装置均省略)______.
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向E装置右管中加适量水;
第二______.
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面.此时应进行的操作是______.
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m=______.
解:(1)为保证NO和NO2完全被吸收以及被空气中氧气氧化,应通入氮气,则应选择B装置,故答案为:B;
(2)浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验,则可加水稀释,这样就不会氧化指示剂了,故答案为:将C中的溶液加适量水稀释;
(3)生成的混合气体经过水充分吸收后生成NO,从④进气,可用量气装置测量体积,最后应连接E装置中的⑨,
故答案为:③④⑤⑨;
(4)NO易被氧化,应排除空气,实验前应通入足量的氮气,故答案为:打开a,通足量N2,排净装置中的空气;
(5)读数时乙管的液面高于甲管的液面,应向下移动乙管,使甲、乙两管液面在同一水平面上,
故答案为:向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)C中发生3NO2+H2O=2HNO3+NO,生成nmolHNO3,则应有1.5nmolNO2,生成0.5nmolNO,所以原混合气体中NO为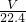 mol-0.5nmol,体积为(V-11.2n)L,1.5nmolNO2的体积为33.6nL,则二者的比值为m=
mol-0.5nmol,体积为(V-11.2n)L,1.5nmolNO2的体积为33.6nL,则二者的比值为m= ,
,
故答案为: .
.
分析:(1)为保证NO和NO2完全被吸收以及被空气中氧气氧化,应通入氮气;
(2)浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验,则可加水稀释;
(3)生成的混合气体经过水充分吸收后生成NO,可用量气装置测量体积;
(4)NO易被氧化,应排除空气;
(5)应向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)C中发生3NO2+H2O=2HNO3+NO,根据方程式计算.
点评:本题较为综合,涉及气体的制备、收集以及测定等方面的考查,题目难度中等,注意制备气体的原理以及实验装置,根据反应的相关方程式计算.
(2)浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验,则可加水稀释,这样就不会氧化指示剂了,故答案为:将C中的溶液加适量水稀释;
(3)生成的混合气体经过水充分吸收后生成NO,从④进气,可用量气装置测量体积,最后应连接E装置中的⑨,
故答案为:③④⑤⑨;
(4)NO易被氧化,应排除空气,实验前应通入足量的氮气,故答案为:打开a,通足量N2,排净装置中的空气;
(5)读数时乙管的液面高于甲管的液面,应向下移动乙管,使甲、乙两管液面在同一水平面上,
故答案为:向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)C中发生3NO2+H2O=2HNO3+NO,生成nmolHNO3,则应有1.5nmolNO2,生成0.5nmolNO,所以原混合气体中NO为
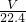 mol-0.5nmol,体积为(V-11.2n)L,1.5nmolNO2的体积为33.6nL,则二者的比值为m=
mol-0.5nmol,体积为(V-11.2n)L,1.5nmolNO2的体积为33.6nL,则二者的比值为m= ,
,故答案为:
 .
.分析:(1)为保证NO和NO2完全被吸收以及被空气中氧气氧化,应通入氮气;
(2)浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验,则可加水稀释;
(3)生成的混合气体经过水充分吸收后生成NO,可用量气装置测量体积;
(4)NO易被氧化,应排除空气;
(5)应向下移动乙管,使甲、乙两管液面在同一水平面上;
(6)C中发生3NO2+H2O=2HNO3+NO,根据方程式计算.
点评:本题较为综合,涉及气体的制备、收集以及测定等方面的考查,题目难度中等,注意制备气体的原理以及实验装置,根据反应的相关方程式计算.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
| |||||||||||||||||||||||||||||
 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题:



