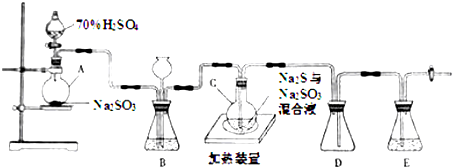
题目内容
2.下列有关实验叙述正确的是ad(填序号).a.金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中
b.称量NaOH固体时,将NaOH直接放在托盘上的纸上
c.试管、烧杯、量筒、集气瓶均不能用酒精灯直接加热
d.湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,其颜色最终变为白色
e.配制稀硫酸时,先沿烧杯内壁缓缓注入浓硫酸,再向烧杯中缓缓加水.
分析 a.钠易被氧气中氧气氧化生成氧化钠,钠也能和水反应生成NaOH和氢气,为防止钠变质要隔绝空气和水;
b.氢氧化钠具有强腐蚀性,称量氢氧化钠时要防止腐蚀托盘;
c.试管能用酒精灯直接加热;
d.氯气和水反应生成HCl和HClO,所以其溶液呈酸性,次氯酸有漂白性,能漂白有色物质;
e.配制稀硫酸时,要将浓硫酸倒入水中.
解答 解:a.钠易被氧气中氧气氧化生成氧化钠,钠也能和水反应生成NaOH和氢气,为防止钠变质要隔绝空气和水,钠密度大于煤油、石蜡油且和煤油、石蜡油不反应,所以金属钠在空气中会迅速被氧化,因此通常保存在煤油或石蜡油中,故正确;
b.氢氧化钠具有强腐蚀性,称量氢氧化钠时要防止腐蚀托盘,所以称量氢氧化钠时要放置在烧杯中,故错误;
c.试管能用酒精灯直接加热,烧杯需要垫石棉网,量筒和集气瓶不能加热,故错误;
d.氯气和水反应生成HCl和HClO,所以其溶液呈酸性,次氯酸有漂白性,能漂白有色物质,所以湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,其颜色先变红色后褪色,所以最终变为白色,故正确;
e.配制稀硫酸时,要将浓硫酸倒入水中,且用玻璃棒不断搅拌,防止局部过热而溅出液体,故错误;
故选ad.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生基本实验操作能力及实验原理,明确操作规范性及物质性质是解本题关键,题目难度不大.

练习册系列答案
相关题目
12.下列过程中,没有颜色变化的是( )
| A. | 石蕊试剂滴入稀盐酸 | |
| B. | 酚酞试剂滴入氢氧化钠溶液 | |
| C. | 食盐溶液加水稀释 | |
| D. | 干燥的氯气通过刚采摘的红色的鲜花 |
13.用下列装置进行相应实验,装置正确且能达到实验目的是( )
| A. | 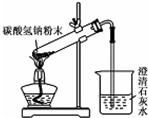 用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. |  用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 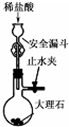 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
7.甲同学将Na2O2分别与H2O和浓盐酸反应,有如下现象:
请完成下列问题:
实验I中:
(1)该反应是放热反应(填“放热”或“吸热”).
(2)反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)证明无色无味气体是氧气的方法是将带火星的木条放在试管口,复燃则证明是氧气.
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O.
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
实验I中:
(1)该反应是放热反应(填“放热”或“吸热”).
(2)反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)证明无色无味气体是氧气的方法是将带火星的木条放在试管口,复燃则证明是氧气.
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O.
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
12.联苯是一种芳香烃,结构为两个苯环被一条单键连接,其一氯代物和二氯代物种类数分别是( )
| A. | 3、12 | B. | 3、10 | C. | 5、12 | D. | 5、10 |
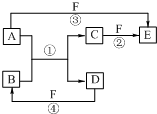 A、B、C、D、E、F六种物质的相互转化关系如右图所示.图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如右图所示.图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应.